| Kupfer 29Cu | ||||||
| engl. Copper; lat. cuprum („Erz aus Zypern“) | ||||||
|
Die
typische, rötlich-glänzende Kupferfarbe ist ein unverkennbares
Merkmal dieses Schwermetalls. Reines Kupfer ist zäh und trotzdem gut bearbeitbar,
es lässt sich gut zu Blechen und Drähten formen.
Nach Silber besitzt es die zweitbeste elektrische Leitfähigkeit und Wärmeleitfähigkeit aller Metalle. Mit Zink, Zinn, Nickel, Silber oder Gold erhält man typische Kupferlegierungen: Bronze enthält zum Beispiel viel Kupfer und wenig Zinn. Messing ist eine Legierung aus Kupfer und Zink. Rotgold enthält bis zu einem Drittel Anteil Kupfer.
An feuchter Luft bildet sich auf der Oberfläche des Kupfers allmählich eine grünliche Patina, die im Wesentlichen aus Malachit besteht. Die Patina schützt das darunter liegende Kupfer vor weiterer Korrosion, daher ist Kupferblech für die Abdeckung von Türmen und Dächern gut geeignet. Nach dem Dachdecken zeigt das Dach zunächst die hellrote Kupferfarbe. Nach einiger Zeit wechselt die Farbe in ein dunkles Rot, das durch Kupfer(I)-oxid verursacht wird. Später wird das Dach noch dunkler, und es entsteht schwarzes Kupfer(II)-oxid. Aber erst nach einigen Jahren bildet sich unter Einwirkung von Kohlenstoffdioxid, Luft und Wasser die blaugrüne Patina: 2 Cu + CO2 + H2O + O2
Beim Erhitzen eines Kupferblechs mit der nichtleuchtenden Flamme eines Bunsenbrenners bilden sich bunte Anlauffarben, die zunächst durch Interferenz der entstehenden, dünnen Oxidschicht zu erklären sind. Dann bildet
sich eine Schicht von schwarzem Kupfer(II)-oxid CuO. Darunter findet man oft eine mattrote Schicht von Kupfer(I)-oxid Cu2O. Dabei finden diese beiden Reaktionen statt:
2 Cu + O2 4 Cu + O2 Eine Brennerflamme vermag
das oxidierte Blech wieder zu reduzieren. Dieser Effekt verschwindet aber
sofort wieder, sobald die Flamme weggenommen wird und das heiße Blech erneut oxidiert. Streut man feines
Kupferpulver in eine Brennerflamme, verbrennt das Pulver teilweise, und es zeigen sich grüne Leuchterscheinungen. Diese rühren daher,
dass das Kupferpulver an der Oberfläche oxidiert und das entstehende
Produkt die Flammenfarbe beeinträchtigt.
Unter Luftabschluss ist das Metall widerstandsfähig gegen Salzsäure in jeder Konzentration und gegen verdünnte Schwefelsäure. Heiße, konzentrierte Schwefelsäure reagiert mit Kupfer
nicht unter Wasserstoffentwicklung, sondern bildet Schwefeldioxid, Kupfer(II)-sulfat und Wasser. Mit Salpetersäure bildet sich grünes
Kupfer(II)-nitrat und das rotbraune Gas Stickstoffdioxid:
Salpetersäure + Kupfer
Kupfersalze und auch Kupferminerale lassen sich mit verschiedenen Vorproben an typischen Phänomenen erkennen:
|
Kupfer
als essenzielles Spurenelement ist für das
Funktionieren von mindestens 16 Enzymen notwendig. Bei der Bildung von
Hämoglobin spielt es eine bedeutende Rolle. Die Synthese des Pigments
Melanin, das in der Haut und in den Haaren vorhanden ist, ist ebenfalls
von diesem Spurenelement abhängig. Auch der Aufbau der schützenden
Sicht um die Nervenfasern wird unterstützt. Ein Kupfermangel kann
Symptome wie Blutarmut, Störung der Nervenzellen, Haut- und Haarpigmentstörungen
oder Bindegewebsstörungen hervorrufen. Die tägliche Kupferzufuhr
erfolgt vor allem über Lebensmittel wie Leber, Miesmuscheln,
Linsen, Erbsen, Bohnen, Nüsse aller Art und Käse.
Interessant ist das Phänomen,
dass einige wirbellose Tiere wie Tintenfische, Schnecken oder bestimmte
Spinnenarten blaues Blut haben. Bei diesen Tieren transportiert das Kupferprotein
Hämocyanin den Sauerstoff im Blut.
Die Speicherung von Kupfer
erfolgt vor allem in der Leber. Der tägliche Bedarf liegt beim Menschen
nur etwa bei einem Milligramm. Die Aufnahme von zu viel Kupfer kann zu einer Vergiftung
führen. Trinkwasser kann Kupfer-Ionen enthalten, wenn die Wasserleitungen
aus Kupfer bestehen und das Wasser längere Zeit darin steht. Besonders
problematisch ist es, wenn Kinder aus einem kupfernen Behälter trinken –
beispielsweise aus einem Kännchen für Zimmerpflanzen
– in dem das Wasser längere Zeit stehen blieb. Hier besteht das Problem
darin, dass sich auch lösliche Kupfersalze bilden. Das chronische
Symptom wurde erstmals in Indien und in Deutschland beobachtet (Indian/German
Childhood Cirrhosis). Bei diesen Kindern traten schwere Leberzirrhosen
und eine Schwächung des Immunsystems auf. Das Essen oder Trinken von
Kupfersalzen in der Dosis von einigen Gramm löst akuten Brechreiz
aus. Dadurch wird das Gift sofort wieder ausgeschieden. In noch höheren
Dosen können Kupfersalze aber auch tödlich wirken. |
Häufigkeit weniger häufig
Kupfer kommt mit einem Massenanteil von 0,01% in der Erdhülle vor und ist etwas weniger häufig als Zink. Das Metall tritt in der Natur als Kupfer gediegen auf. Eines der größten Kupferstücke barg man im Jahre 2001 vom Boden des Lake Superior. Der Brocken umfasste 5,5 × 2,5 × 0,37 Meter und wog etwa 14,5 Tonnen. Lit [23]
Aus den Kupfererzen,
den Sulfiden wie Buntkupferkies, Chalkopyrit, Chalkosin, den Oxiden wie Cuprit, den
Carbonaten wie Malachit, den Chloriden
oder den Arseniden kann das Kupfer gewonnen werden. Die größte Tagebaustätte
der Welt für Kupfererze liegt in Chile, sie misst etwa sieben Quadratkilometer
und ist 600 Meter tief. [Lit 75]
Andere bedeutende Förderländer sind China, Peru, die USA (Arizona, Montana,
Utah und New Mexico), Australien, Congo, Kanada, Zambia, Russland und Mexiko. |
|
Kupfer war vermutlich das erste Metall, das schon vor 8000 Jahren verarbeitet wurde. Mit der Gewinnung des Kupfers aus Erzen begann die Kupferzeit und
endete die Steinzeit. Um 4500 vor Christus entdeckte man die Möglichkeit, aus Erzen Kupfer zu gewinnen. Davor bearbeitete man das Metall durch Hämmern und Schmieden von elementaren Vorkommen in gediegener Form. Die alten Ägypter förderten die Kupfererze im Untertagebau. Das bedeutendste Vorkommen lag zu dieser Zeit auf der Sinai-Halbinsel. Weitere Vorkommen gab es im Altertum südlich des Toten Meeres, in Ostarabien, im Norden des Irak und in Spanien. In Indien und im antiken Griechenland verbesserte man die
Eigenschaften des Metalls durch das Legieren mit Zinn zu Bronze oder mit
Zink zu Messing. Der Koloss von Rhodos war eine 30 Meter hohe Bronze- oder
Kupferstatue, die den Sonnengott Helios darstellte. Lit
[73] Er stand
in der Hafeneinfahrt von Rhodos. Ein Erdbeben um 226 vor Christus brachte die
Skulptur zum Einsturz.
Die Römer stellten um 100 nach Christus erstmals kupferne Wasserleitungen her. Lit [72] Sie gewannen das Erz in Zypern, der Name Kupfer geht auf den lateinischen Begriff aes cyprium („Erz aus Zypern“) zurück. Im Mittelalter war Deutschland der bedeutendste Kupferproduzent Europas. Im 15. und 16. Jahrhundert waren zahlreiche Bergwerke in Besitz des Kaufmanns Jakob Fugger (1459–1525), der den Kupferhandel zu dieser Zeit beherrschte. In der Alchemie diente das Phänomen, dass Kupfer durch unedle Metalle aus Lösungen seiner Salze freigesetzt wird, lange Zeit als Beweis für die Möglichkeit einer Umwandlung von Metallen in andere (Transmutationen). Erst Robert Boyle (1627–1691) klärte im Jahre 1661 das Missverständnis auf und erklärte das Phänomen durch die Verdrängung des Metalls aus einer Salzlösung durch Metalle wie Eisen oder Zink. Dem Kupfer wurde in der Alchemie das Venuszeichen zugeordnet (erstes Symbol von links): 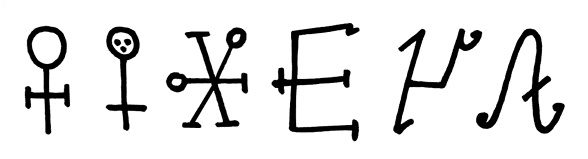 Der mühsame Abbau der
Kupfererze von Hand mit Schlägel und Eisen wurde im 17. Jahrhundert
durch den Einsatz von Schwarzpulver revolutioniert. Trotzdem war der Bergbau
noch sehr mühsam, da das 50 Zentimeter tiefe Bohrloch für die Sprengung
immer noch von Hand geschlagen werden musste. Allein dafür benötigte ein Bergmann viele Stunden. Das Ergebnis einer Sprengung waren dann nur einige Brocken Kupfererz.
|
Der
Kupfergehalt der Erze ist relativ gering. Zur Anreicherung
werden die Erze
gemahlen und mit Wasser verrührt. Die Gangart des
Gesteins, die aus
Quarz oder Silicaten bestehen kann, lässt sich leicht
benetzen, Metallsulfide
stoßen Wasser dagegen ab. Gibt man einen Ölschaum
hinzu, schwimmen
die schweren Erzteilchen auf, so lassen sie sich leicht
abschöpfen.
Dieses Verfahren nennt man Schwimmaufbereitung oder Flotation.
Ein auf diese Weise angereichertes sulfidisches Kupfererz wie Chalkopyrit wird dann in Öfen zu Kupferstein, einem Gemisch aus Kupfersulfid und
Eisensulfid, geröstet. Das entstehende Schwefeldioxid verdampft, dieses
wird zur Schwefelsäureherstellung benötigt. Gleichzeitig entstehende
Eisenverbindungen entfernt man im „Schmelzen“ durch Verschlacken bei 1400 °C
unter Zugabe von kieselsäurehaltigen Zusatzstoffen. Der Kupferstein
wird verflüssigt und zusammen mit Zuschlägen wie Quarzsand in
einen Konverter gegossen. Durch das „Blasen“ mit Luft wird das enthaltene
Eisensulfid zu Eisenoxid oxidiert. Dieses bildet mit den Zuschlägen
Schlacke, die man abgießen kann. Im nächsten Schritt wird beim
Blasen der von Eisen-Verbindungen befreite Kupferstein zu Kupfer(I)-oxid
Cu2O oxidiert. Dieses wird dann durch das restliche Kupfersulfid
aus dem Kupferstein zu Rohkupfer oder Schwarzkupfer reduziert. [Lit 4, 5 und 35]
Rohkupfer besitzt einen Reinheitsgrad von 90 bis 97 Prozent. Dies reicht für viele Anwendungen nicht aus, insbesondere die Elektroindustrie benötigt hochreines Kupfer. Die Herstellung des Reinkupfers erfolgt durch die Kupfer-Raffination in einer elektrolytischen Lösung. Legt man eine Spannung an, geht
das Garkupfer zusammen mit allen unedleren Metallen an der Anode in Lösung. Die edleren Metalle fallen ungelöst als Anodenschlamm an den Boden. An der Kathode scheidet sich Reinkupfer mit einer Reinheit von etwa 99,95 Prozent ab.
|
| Experiment:
Kupfer reagiert mit Schwefel Experimente mit Kupferacetat Experiment: Erhitzen eines Kupferbriefs Demonstrationen zum Kupfer-Kreislauf |
|
|