Didaktische Bemerkungen
Kreisreaktionen sind
ein erster Hinweis darauf, dass sich die einfachen Stoffsysteme zu höher
organisierten Systemen entwickeln können. Als einfache Kreisreaktion
gilt jede Hin- und Rückreaktion, so auch bei der Synthese von Kupferacetat
und dessen analytischer Zerlegung (>Experiment).
Eine schon in der Antike bekannte Kreisreaktion ist die technische
Nutzung des Kalks:
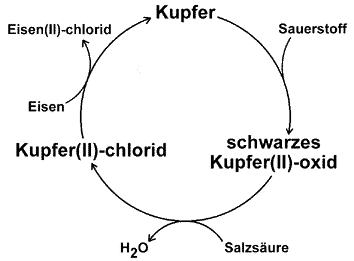
Einfacher Kupferkreislauf
Ein für die Schule
besonders schöner Kreislauf ergibt sich aus den Experimenten beim
Erhitzen eines Kupferbriefs. Das bei dem Experiment
gebildete schwarze Kupfer(II)-oxid auf
dem Kupferbrief kann mit verdünnter Salzsäure zu Kupfer(II)-chlorid
umgewandelt werden. Man legt die oxidierten Briefe einfach in eine Petrischale
mit 10%iger Salzsäure. Legt man einen Eisennagel in die entstandene
Lösung, scheidet sich in einem elektrochemischen Vorgang elementares
Kupfer auf dem Nagel ab.
Erweiterter Kupferkreislauf
Komplizierter ist der
erweiterte Kupferkreislauf, bei dem das Kupfer über zwei Zwischenschritte
wieder erhältlich ist. Liegen die oxidierten Kupferbriefe lange in
kohlendioxidhaltiger und feuchter Luft, bilden sich grünliche Schichten.
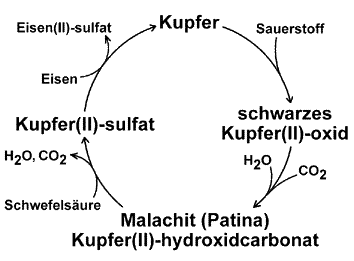
Im Freien bildet die
feuchte Luft zusammen mit dem Kohlenstoffdioxid auf der Oberfläche
von oxidierten Kupferblechen allmählich einen grünlichen Überzug,
der auch als Patina bezeichnet wird. Dieser Vorgang dauert in der Regel
mehrere Jahre. Die Patina schützt das darunter liegende Kupfer vor
weiterer Korrosion, daher ist Kupferblech für die Abdeckung von Türmen
und Dächern gut geeignet (genaue Reaktionsgleichung siehe >Kupfer).
Der Überzug besteht im wesentlichen aus Malachit, einem Stoff der
in der Natur als grünes Mineral vorkommt. Malachit
war früher auch ein wichtiges Pigment.
Mit verdünnter Schwefelsäure
kann der Malachit in Kupfer(II)-sulfat umgewandelt werden. Dazu füllt
man eine Petrischale zur Hälfte mit 10%iger Schwefelsäure und
gibt einen Spatel pulverisierten Malachit hinzu. Unter Aufbrausen löst
sich das Pulver auf, und es bildet sich eine bläuliche Lösung.
Legt man einen Eisennagel in diese Lösung, kann das Abscheiden des
Kupfers besonders schön beobachtet werden. Auch andere hineingelegte
Metalle überziehen sich mit einer Kupferschicht.
Ausblick:
Kreisreaktionen sind die wesentlichen Voraussetzungen
für Stoffkreisläufe in der Natur, zum Beispiel beim Kalkkreislauf.
Diese kommen in der Natur in großer Vielfalt vor. Eine besonders
komplizierte Kreisreaktion stellt der Citronensäurezyklus im Verdauungskreislauf
des menschlichen Körpers dar. In der Natur sind chemische Kreisreaktionen
oft in ökologische Kreisläufe eingebunden, so auch beim Kohlenstoffkreislauf
oder beim Stickstoffkreislauf. Ökologische
Kreisläufe sind sehr komplex organisiert. Bei ihnen unterhalten die
in den Kreislauf eingebundenen Systeme Rückkopplungseffekte nach komplizierten
Mustern (siehe auch >chemische Gleichgewichte).
Die Kenntnis dieser Muster ermöglicht uns die Vorhersage von langfristigen
Auswirkungen. Wenn wir zusätzlich Kohlenstoffdioxid in den Kohlenstoffkreislauf
einbringen, wird der Treibhauseffekt
beschleunigt.
Entsorgung: Durch das Hineinlegen von Eisennägeln, werden der Lösung alle Kupfer-Ionen entzogen, so dass die Lösung nicht mehr gewässergefährdend ist. Dies ist an der farblosen Lösung zu erkennen. Die Reste der verdünnten Schwefelsäure werden mit viel Wasser verdünnt, dann mit verdünnter Natronlauge neutralisiert und in den Abguss gegeben. Die verkupferten Eisennägel bewahrt man in der Sammlung als Demonstrationsobjekte auf. Sie werden mit viel Wasser abgespült und dann getrocknet.
Literatur
|