Schwefeldioxid
SO2
CAS 7446-09-5
Schwefeldioxid
Sulfur dioxide
64,064 g/mol
0,5 ml/m3 oder 1,3 mg/m3 (TRGS 900)
2,9285 g/l (Gas, 0 °C, 1013 hPa)
(Schwefeldioxid zu Luft = 2,27)
−75,45 °C
−10,02 °C
Konz. bei 20 °C 112,7 g/l
0,5 ml/m3 oder 1,3 mg/m3 (TRGS 900)
2,9285 g/l (Gas, 0 °C, 1013 hPa)
(Schwefeldioxid zu Luft = 2,27)
−75,45 °C
−10,02 °C
Konz. bei 20 °C 112,7 g/l
Farbloses, stark stechend riechendes Gas


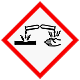

Gefahrenklassen + Kategorie
Gase unter Druck, verdicht. Gas
Akute Toxizität inhalativ 3
Spez. Zielorgantoxizität 1
Ätz/Reizwirkung auf die Haut 1B
Gase unter Druck, verdicht. Gas
Akute Toxizität inhalativ 3
Spez. Zielorgantoxizität 1
Ätz/Reizwirkung auf die Haut 1B
HP-Sätze (siehe Hinweis)
H 280, 314, 331, 370 (Atmungsorgane)
P 260, 280.1-3+7, 304+340, 303+361+353, 305+351+338, 315
Entsorgung besondere Hinweise
H 280, 314, 331, 370 (Atmungsorgane)
P 260, 280.1-3+7, 304+340, 303+361+353, 305+351+338, 315
Entsorgung besondere Hinweise
Nach der deutschen RISU dürfen Gasflaschen mit Schwefeldioxid an Schulen nicht gelagert werden. Werdende oder stillende Mütter dürfen mit diesem Stoff nicht arbeiten. Beim Erhitzen von Schwefel im Reagenzglas kann der Schwefel zu brennen beginnen. Dabei verbrennt er zu Schwefeldioxid. Bei allen Arbeiten, bei denen Schwefeldioxid entsteht, wird im Abzug gearbeitet. Der niedrige Arbeitsplatzgrenzwert ist zu berücksichtigen.
Wirkung auf den menschlichen Körper
Schwefeldioxid ist ein starkes Atemgift. Schon geringe Konzentrationen von 0,04 Prozent in der Luft können Husten, Atemnot oder eine Entzündung der Atemwege und der Schleimhäute hervorrufen. Bei Vergiftungsfällen sollte viel frische Luft geatmet und gegebenenfalls auch künstlich beatmet werden. Lösungen von Schwefeldioxid in Wasser verätzen die Magenwände, wenn sie getrunken werden.
Chemisch-physikalische Eigenschaften
Schwefeldioxid ist ein farbloses, stechend riechendes Gas, das nicht brennbar ist. Bei −10 °C erstarrt es zu einer farblosen Flüssigkeit. Bei Zimmertemperatur (+20 °C) lösen sich in einem Liter Wasser ungefähr 40 Liter Schwefeldioxid. Bei der Lösung von Schwefeldioxid in Wasser entsteht auch Schweflige Säure. Allerdings liegt das Gleichgewicht dieser Reaktion weit auf der linken Seite, so dass sich nur relativ wenig Schweflige Säure bildet:
Das Gas ist nicht nur in Wasser, sondern auch in vielen organischen Lösungsmittel gut löslich. Es ist etwa 2,3 Mal schwerer als Luft. Organische Farbstoffe werden durch Schwefeldioxid entfärbt. Der Effekt beruht – im Gegensatz zum Bleichen mit Sauerstoff – nicht auf einer Oxidation, sondern auf der reduzierenden Wirkung des Schwefeldioxids. Es dient daher zum Bleichen von Stroh oder Wolle. Schwefeldioxid wirkt auf viele Organismen toxisch. Mikroorganismen werden in ihrem Wachstum gehemmt. Besonders empfindlich reagieren auch Nadelbäume. Schwefeldioxid in der Luft – zum Beispiel aus Abgasen – wird teilweise zu Schwefeltrioxid SO3 oxidiert:
Schwefeltrioxid bildet beim Kontakt mit der Luftfeuchtigkeit in den Wolken Schwefelsäure, während das Schwefeldioxid mit Wasser teilweise zu Schwefliger Säure reagiert. Im sauren Regen sind daher beide Säuren enthalten. Der saure Regen führt zur Versauerung der Gewässer, und er kann ein Waldsterben auslösen. Es gibt auch natürliche Emissionsquellen für Schwefeldioxid: In der Umgebung von Vulkanen oder heißen Quellen kann der Schwefeldioxidgehalt um das Vielfache erhöht sein.
Schwefeldioxid ist nicht brennbar, es kann jedoch in Gegenwart von Katalysatoren zu Schwefeltrioxid oxidiert werden und ist daher ein wichtiges Zwischenprodukt zur Herstellung von Schwefelsäure. Beim Erhitzen mit Wasserstoff in glühenden Röhren wird es zu Schwefel oder zu Schwefelwasserstoff reduziert. Mit Chlor reagiert es zu Sulfurylchlorid SO2Cl2, einem wichtigen Zwischenprodukt in der organischen Chemie. Mit Nitraten entstehen beim Erhitzen Sulfate und Stickoxide.
Schwefeldioxid ist ein starkes Atemgift. Schon geringe Konzentrationen von 0,04 Prozent in der Luft können Husten, Atemnot oder eine Entzündung der Atemwege und der Schleimhäute hervorrufen. Bei Vergiftungsfällen sollte viel frische Luft geatmet und gegebenenfalls auch künstlich beatmet werden. Lösungen von Schwefeldioxid in Wasser verätzen die Magenwände, wenn sie getrunken werden.
Chemisch-physikalische Eigenschaften
Schwefeldioxid ist ein farbloses, stechend riechendes Gas, das nicht brennbar ist. Bei −10 °C erstarrt es zu einer farblosen Flüssigkeit. Bei Zimmertemperatur (+20 °C) lösen sich in einem Liter Wasser ungefähr 40 Liter Schwefeldioxid. Bei der Lösung von Schwefeldioxid in Wasser entsteht auch Schweflige Säure. Allerdings liegt das Gleichgewicht dieser Reaktion weit auf der linken Seite, so dass sich nur relativ wenig Schweflige Säure bildet:
SO2 + H2O  H2 SO3
H2 SO3
Das Gas ist nicht nur in Wasser, sondern auch in vielen organischen Lösungsmittel gut löslich. Es ist etwa 2,3 Mal schwerer als Luft. Organische Farbstoffe werden durch Schwefeldioxid entfärbt. Der Effekt beruht – im Gegensatz zum Bleichen mit Sauerstoff – nicht auf einer Oxidation, sondern auf der reduzierenden Wirkung des Schwefeldioxids. Es dient daher zum Bleichen von Stroh oder Wolle. Schwefeldioxid wirkt auf viele Organismen toxisch. Mikroorganismen werden in ihrem Wachstum gehemmt. Besonders empfindlich reagieren auch Nadelbäume. Schwefeldioxid in der Luft – zum Beispiel aus Abgasen – wird teilweise zu Schwefeltrioxid SO3 oxidiert:
2 SO2 + O2  2 SO3
2 SO3
Schwefeltrioxid bildet beim Kontakt mit der Luftfeuchtigkeit in den Wolken Schwefelsäure, während das Schwefeldioxid mit Wasser teilweise zu Schwefliger Säure reagiert. Im sauren Regen sind daher beide Säuren enthalten. Der saure Regen führt zur Versauerung der Gewässer, und er kann ein Waldsterben auslösen. Es gibt auch natürliche Emissionsquellen für Schwefeldioxid: In der Umgebung von Vulkanen oder heißen Quellen kann der Schwefeldioxidgehalt um das Vielfache erhöht sein.
Schwefeldioxid ist nicht brennbar, es kann jedoch in Gegenwart von Katalysatoren zu Schwefeltrioxid oxidiert werden und ist daher ein wichtiges Zwischenprodukt zur Herstellung von Schwefelsäure. Beim Erhitzen mit Wasserstoff in glühenden Röhren wird es zu Schwefel oder zu Schwefelwasserstoff reduziert. Mit Chlor reagiert es zu Sulfurylchlorid SO2Cl2, einem wichtigen Zwischenprodukt in der organischen Chemie. Mit Nitraten entstehen beim Erhitzen Sulfate und Stickoxide.
Schwefel verbrennt mit blauer Flamme. Dabei entsteht ein stechend riechendes und toxisches Gas, das die Atemwege reizt. Es handelt sich hierbei um Schwefeldioxid:

Verbrennen von Schwefel in einem Standzylinder.
Ein weiteres wichtiges Verfahren zur Schwefeldioxidgewinnung stellt das Rösten des Minerals Pyrit oder anderer Sulfiderze dar. Der Pyrit wird auf über 800 °C erhitzt, wobei sich Röstgase bilden:
Das Schwefeldioxid wird durch eine Absorption mit kaltem Wasser aus den Röstgasen abgetrennt und danach wieder aus dem Wasser mit Wasserdampf ausgetrieben. Daneben existieren noch weitere Verfahren, insbesondere entsteht Schwefeldioxid als Nebenprodukt bei vielen chemischen Reaktionen.
S + O2  SO2 ΔHR = −297 kJ/mol
SO2 ΔHR = −297 kJ/mol

Verbrennen von Schwefel in einem Standzylinder.
Ein weiteres wichtiges Verfahren zur Schwefeldioxidgewinnung stellt das Rösten des Minerals Pyrit oder anderer Sulfiderze dar. Der Pyrit wird auf über 800 °C erhitzt, wobei sich Röstgase bilden:
4 FeS2 + 11 O2  2 Fe2O3 + 8 SO2
2 Fe2O3 + 8 SO2
Das Schwefeldioxid wird durch eine Absorption mit kaltem Wasser aus den Röstgasen abgetrennt und danach wieder aus dem Wasser mit Wasserdampf ausgetrieben. Daneben existieren noch weitere Verfahren, insbesondere entsteht Schwefeldioxid als Nebenprodukt bei vielen chemischen Reaktionen.
Schwefeldioxid ist ein wichtiges Zwischenprodukt zur Schwefelsäureherstellung. Es dient in der chemischen Industrie auch zur Herstellung von Salzen wie Sulfide, Sulfite, Thiosulfate oder Dithionite. In verflüssigter Form wird es als Lösungsmittel gebraucht. Man benötigt es bei der Sulfochlorierung zur Herstellung von Waschmitteln und zum Bleichen von Wolle und Stroh. In der Lebensmittelbranche dient es zum Konservieren von Obst und Gemüse und zum Ausräuchern von Ungeziefer und Krankheitserregern. Zum Schwefeln von Wein gibt es mehrere Möglichkeiten: Man kann Schwefel in den leeren Weinfässern verbrennen, oder man gibt zu dem Wein einen Stoff wie Kaliumdisulfit, der Schwefeldioxid abspaltet.
Weitere Infos und Medien
Gefahren für das Ökosystem Wald
Doppelkontaktverfahren zur Herstellung von Schwefelsäure
Weitere Infos und Medien
Gefahren für das Ökosystem Wald
Doppelkontaktverfahren zur Herstellung von Schwefelsäure
© Thomas Seilnacht / Benutzerhandbuch / Lizenzbestimmungen / Impressum / Datenschutz / Literaturquellen