| Inhalt Gruppenmerkmal Unterteilung Eigenschaften Herstellung Verwendung | 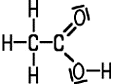
Ethansäure, Essigsäure | Die
Carbonsäuren stellen eine Gruppe organischer Verbindungen dar, die
im Molekül mindestens eine COOH-Gruppe (Carboxy-Gruppe) enthalten.
Ein bekannter Vertreter ist Ethansäure. |
Vorkommen und Gruppenmerkmal
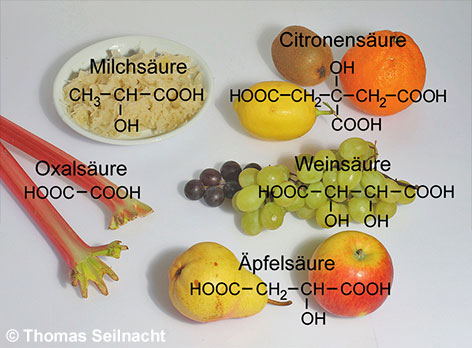
Die Carbonsäuren beinhalten eine große Gruppe organischer Säuren, die in der Natur weit verbreitet sind. Zu ihnen gehört beispielsweise die Ameisensäure oder die Essigsäure. In reiner Form wirken einige der Carbonsäuren stark ätzend und toxisch, in den Nahrungsmitteln nehmen wir aber auch geringe Mengen auf: Sauerkraut ist zum Beispiel mit Milchsäure vergoren, Trauben enthalten natürliche Weinsäure, Citrusfrüchte Citronensäure, Äpfel und Birnen Äpfelsäure und Rhabarber sogar Oxalsäure.
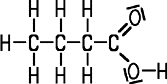
Das kennzeichnende Merkmal des Carbonsäure-Moleküls ist die COOH-Gruppe, die Carboxy-Gruppe (veraltet auch Carboxyl-Gruppe). Gesättigte Carbonsäuren ohne Doppelbindungen im Kohlenstoffgerüst sind gesättigt, sie werden Alkansäuren genannt. Nach der Nomenklatur werden die Namen nach dem Grundgerüst vergleichbarer Alkane gebildet, wobei die Endung -säure angehängt wird. Carbonsäuren werden auch Fettsäuren genannt, da sie Fett-Moleküle aufbauen.
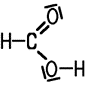
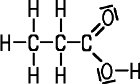
| Ameisensäure | Essigsäure | Propionsäure | Buttersäure |

|

|

|

|
|

|
|
|
| Methansäure | Ethansäure | Propansäure | Butansäure |
Unterteilung der Carbonsäuren
Besitzen die Carbonsäuren
in ihrer Kohlenstoff-Kette mindestens eine Doppelbindung, handelt es sich
um ungesättigte Fettsäuren. Diese
sind im Vergleich zu den gesättigten Fettsäuren
wie Stearinsäure oder Palmitinsäure daran zu erkennen, dass sie eine oder mehrere Doppelbindungen im Fettsäure-Molekül
enthalten, beispielsweise bei der Ölsäure oder der Linolsäure.
Bei den ungesättigten Fettsäuren verläuft die Probe
mit Bromwasser zum Nachweis von Mehrfachverbindungen positiv.
Ungesättigte Fettsäuren
haben einen niedrigeren Schmelzpunkt, da die Doppelbindungen zu einem Knick
in der Molekülkette führen und die Moleküle nicht mehr so
dicht gepackt werden können. Dadurch sind die Van-der-Waals-Kräfte
zwischen den Ketten schwächer. Bei der Fetthärtung
werden ungesättigte Fettsäuren in gesättigte umgewandelt,
die Schmelzpunkte steigen dadurch.
| Gesättigte und ungesättigte Fettsäuren |
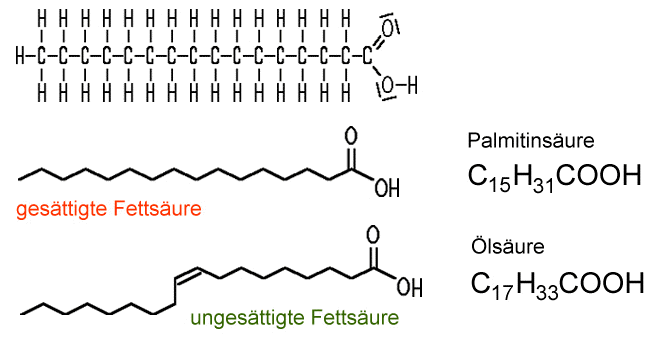 |
| Ungesättigte Fettsäuren haben mindestens eine Doppelbindung in der C-Kette. |
Zu den einfach ungesättigten Fettsäuren zählen zum Beispiel die in pflanzlichen Fetten vorkommende Ölsäure (cis-9-Octadecensäure) oder die Palmitoleinsäure (cis-9-Hexadecensäure), zu den mehrfach ungesättigten mit mehreren Doppelbindungen die Linolsäure (cis-cis-9,12-Octadecadiensäue) oder die Linolensäure (cis-cis-cis-9,12,15-Octadecatriensäure). Nach der Nomenklatur kann die Numerierung am C-Atom mit der Carboxy-Gruppe beginnen oder aber auch umgekehrt vom letzten C-Atom aus, das als Omega bezeichnet wird. Die Zählung vom Omega-Ende aus wird aber meist nur verwendet, wenn die Fettsäuren klassifiziert werden: Die Ölsäure wäre demnach eine Omega-9-Fettsäure. In tierischen Fetten findet man vorwiegend trans-Fettsäuren.
Pflanzenöle werden aus Ölpflanzen gewonnen. Im Gegensatz zu den etherischen Ölen enthalten Pflanzenöle eine Mischung schwer flüchtiger, fetter Öle. Je nach Zusammensetzung variiert die Dichte der pflanzlichen Öle. Eines der schwersten, pflanzlichen Öle ist das Rizinusöl, das aus den Samen der Rizinuspflanze durch Kaltpressen gewonnen wird. Die hohe Dichte wird durch den Hauptbestandteil 12-Hydroxy-9-octadecensäure (Ricinolsäure) verursacht. Rizinusöl ist ein wichtiger Rohstoff für die Kosmetik- und Farbenindustrie.
| Name |
Rohstoff |
Dichte g/cm³ |
| Rapsöl |
Rapssamen |
0,91 |
| Olivenöl |
Steinfrucht des Olivenbaums |
0,91 |
| Sonnenblumenöl |
Sonnenblumenkerne |
0,92 |
| Erdnussöl |
Samen der Erdnuss |
0,92 |
| Distelöl |
Frucht der Färberdistel |
0,92 |
| Sojaöl |
Samen der Sojabohne |
0,93 |
| Leinöl |
Samen der Leinpflanze |
0,93 |
| Rizinusöl |
Samen der Rizinuspflanze |
0,95 |
Dicarbonsäuren sind an ihren zwei COOH-Gruppen zu erkennen. Zu ihnen zählen die im Sauerklee vorkommende Oxalsäure (Ethandisäure), die Malonsäure (Propandisäure), die Bernsteinsäure (Butandisäure) oder die ungesättigte Fumarsäure (trans-Butendisäure) als Beispiel für eine ungesättigte Dicarbonsäure. Die Hydroxycarbonsäuren enthalten zusätzlich mindestens eine OH-Gruppe. Ein einfacher Vertreter dieser Gruppe ist die Milchsäure (Hydroxypropansäure). Zu den Hydroxycarbonsäuren mit mehreren COOH-Gruppen zählen die Citronensäure oder die Weinsäure. Bei den aromatischen Carbonsäuren ist die COOH-Gruppe mit einem Benzolring verbunden wie bei der Benzoesäure. Bei der Phthalsäure handelt es sich um eine aromatische Dicarbonsäure. Ist der Benzolring zusätzlich noch mit einer OH-Gruppe verbunden, erhält man die aromatischen Hydroxycarbonsäuren, zu denen die Gallussäure oder die Salicylsäure gehören.
Eigenschaften
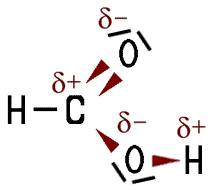
Im Vergleich zu den kurzkettigen Alkoholen liegen die Siedepunkte der kurzkettigen Alkansäuren noch höher, weil die Moleküle an der Carboxy-Gruppe stärker polarisiert sind. Das Wasserstoff-Atom in der Carboxy-Gruppe ist gegensätzlich zum Sauerstoff-Atom der Carbonylgruppe polarisiert. Die Moleküle ziehen sich dadurch untereinander an, es bilden sich Wasserstoffbrückenbindungen. Die kurzkettigen Alkansäure-Moleküle bilden untereinander Dimere, das sind zwei Moleküle, die über zwei Wasserstoffbrücken miteinander verknüpft sind.
| Polarität im Molekül | Intermolekulare Wasserstoffbrücken |
|
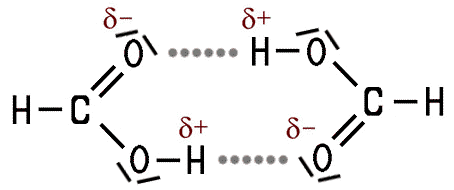 |
| Die Carboxy-Gruppe ist polar, | dadurch wirken zwischen den Molekülen Kräfte. |
Mit zunehmender Kettenlänge
nehmen aufgrund der steigenden Van-der-Waals-Kräfte die Siedepunkte
zu, während die Wasserlöslichkeit sinkt. Die Pentansäure
ist nur noch schlecht wasserlöslich, während die Octansäure
im Wasser gar nicht mehr löslich, dafür aber gut in unpolaren
Lösungsmitteln wie Benzin löslich ist.
| Schmelz und Siedepunkte der Alkansäuren im Vergleich |
|
|
| Mit zunehmender Kettenlänge nehmen die Schmelz- und Siedepunkte zu. |
Die Säurewirkung der
Carbonsäuren beruht auf einer Säure-Base-Reaktion.
Wenn eine Carbonsäure zum Beispiel mit Wasser reagiert, entstehen ein Carboxylat-Ion und das für die Säuren typische H3O+-Ion. Die hohe Polarität begünstigt die Protonenabgabe der Carboxy-Gruppe; entscheidend ist aber die Stabilität des entstehenden Carboxylat-Ions. Mit zunehmender Kettenlänge nimmt der Einfluss des unpolaren Alkylrests zu. Der elektronenschiebende Alkylrest (+I-Effekt) erhöht die Elektronendichte an der Carbonyl-Gruppe, so dass das Proton schwerer abgespalten werden kann und die Säurewirkung schwächer wird. Die Säurestärke
der einfachen Alkansäuren nimmt mit zunehmender Kettenlänge ab.
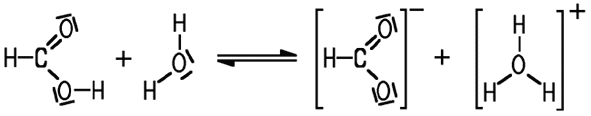
Methansäure + Wasser
Methansäure reagiert
relativ heftig mit einem Magnesiumband (RG im Bild unten links), während
bei der Ethansäure die Reaktion schon langsamer abläuft (2. RG
von links). Die Reaktion mit Magnesium ist zwar nicht ein quantitativer
Maßstab, aber ein grober Hinweis auf die Säurestärke. Buttersäure
(RG ganz rechts) ist nur noch eine relativ schwache Säure.
| Reaktion der Carbonsäuren mit Magnesium | ||||
|
||||
| Film erhältlich auf >DVD |
Bei der Reaktion einer
Carbonsäure mit einem unedlen Metall entstehen unter Wasserstoff-Entwicklung
die Salze der Carbonsäure. Einige der Salze wie Natriumtatrat
oder Natriumcitrat werden als Lebensmittel-Zusatzstoffe
eingesetzt. Die Natrium- und Kaliumsalze der langkettigen Carbonsäuren
entstehen bei der Herstellung von Seifen.
| Name der Säure | Name der Salze | Verwendungszweck |
| Ameisensäure | Formiate | Reinigungsmittel |
| Essigsäure | Acetate | Lebensmittel-Konservierung |
| Propionsäure | Propionate | Früher zur Konservierung |
| Buttersäure | Butyrate | Kunststoffherstellung |
| Stearinsäure | Stearate | Seifen- und Kerzenherstellung |
| Milchsäure | Lactate | Kochsalzersatz Diätnahrung |
| Äpfelsäure | Malate | Lebensmittel-Konservierung |
| Citronensäure | Citrate | Säuerungsmittel |
| Weinsäure | Tartrate | Säuerungsmittel |
| Benzoesäure | Benzoate | Lebensmittel-Konservierung |
Chemische Reaktionen (Beispiele)
a) Eine typische chemische
Reaktion der Carbonsäuren stellt die Ester-Reaktion mit einem Alkohol
dar. Bei der Veresterung
von Glycerin mit drei Fettsäuren erhält man ein Fett-Molekül.
b) Wenn zwei Carbonsäure-Moleküle unter Wasserabspaltung reagieren, erhält man die entsprechenden Carbonsäureanhydride. Aus zwei Essigsäure-Molekülen entsteht zum Beispiel Essigsäureanhydrid. Da dieses beim Vorhandensein von Essigsäure aber sofort wieder zerfallen würde, wählt man in der Praxis andere Herstellungsmöglichkeiten der Anhydride.
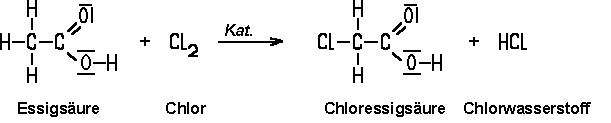
c) Durch eine Substitutionsreaktion lassen sich Halogencarbonsäuren herstellen. Die Stoffe dieser Gruppe sind außergewöhnlich reaktiv. Sie sind auch stärkere Säuren als die Carbonsäuren. Mit Wasser reagieren sie wieder zu der entsprechenden Carbonsäure und Chlorwasserstoff. Durch eine Umsetzung mit Ammoniak erhält man Aminosäuren wie Glycin (Aminoethansäure), die als Bausteine für die Eiweiße von großer Bedeutung sind.
b) Wenn zwei Carbonsäure-Moleküle unter Wasserabspaltung reagieren, erhält man die entsprechenden Carbonsäureanhydride. Aus zwei Essigsäure-Molekülen entsteht zum Beispiel Essigsäureanhydrid. Da dieses beim Vorhandensein von Essigsäure aber sofort wieder zerfallen würde, wählt man in der Praxis andere Herstellungsmöglichkeiten der Anhydride.
c) Durch eine Substitutionsreaktion lassen sich Halogencarbonsäuren herstellen. Die Stoffe dieser Gruppe sind außergewöhnlich reaktiv. Sie sind auch stärkere Säuren als die Carbonsäuren. Mit Wasser reagieren sie wieder zu der entsprechenden Carbonsäure und Chlorwasserstoff. Durch eine Umsetzung mit Ammoniak erhält man Aminosäuren wie Glycin (Aminoethansäure), die als Bausteine für die Eiweiße von großer Bedeutung sind.
| Herstellen der Aminosäure Glycin aus Essigsäure |
|
| Schritt 1: Substitution eines Halogens |
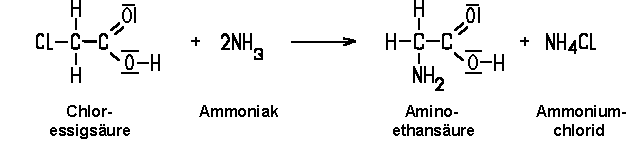
|
| Schritt 2: Umsetzung mit Ammoniak |
Herstellung
Lässt man Wein längere
Zeit an der Luft offen stehen, bildet sich durch eine enzymatische Oxidation
Essigsäure. Im Labor kann man eine Alkansäure mit Hilfe von starken
Oxidationsmitteln aus primären Alkoholen
darstellen. Einfache Alkansäuren können auch durch eine Oxidation
eines Aldehyds dargestellt werden.
Verwendung
Die Verwendung der Carbonsäuren
und ihrer Salze ist vielseitig. Sie dienen als Lebensmittelzusatzstoffe und stellen wichtige Zwischenprodukte für zahlreiche
andere Stoffe und Stoffgruppen der organischen Chemie dar. Sie werden zum Beispiel bei der Herstellung von Riechstoffen, Kunststoffen, Medikamenten oder Farbstoffen benötigt.
Buch individuell erstellen: Basis-Text Carbonsäuren


> Inhaltsverzeichnis
Buch individuell erstellen: Basis-Text Carbonsäuren


> Inhaltsverzeichnis