| Säuren | ||||||||||
Der Säurebegriff im Alltag Säuren im Haushalt Säuren kommen im Alltag häufig vor: Der Essig im Haushalt enthält Essigsäure. In der Milch ist Milchsäure enthalten und im Wein Weinsäure. Säuren
benötigt man zum Haltbarmachen von Lebensmitteln. Sie geben den
Speisen einen sauren Geschmack. Essiggurken, Zitronensaft oder
Sauerkraut schmecken sauer. In der Coca Cola sind Phosphorsäure und Kohlensäure enthalten. Die Magensäure enthält sogar Salzsäure. Säuren als reizende und ätzende Stoffe Ameisen und auch Brennnesseln verwenden Ameisensäure als
Verteidigungsmittel. Die Säure brennt auf der Haut, sie kann
Entzündungen hervorrufen oder die Haut sogar auflösen.
Säuren wirken reizend und ätzend: Wenn sie in die Augen
kommen, können
sie schwere Verätzungen verursachen, im schlimmsten Fall wird man
davon blind. Aus diesem Grund muss man beim Arbeiten mit Säuren im
Labor Schutzbrillen tragen und Schutzhandschuhe anziehen. Die
Batteriesäure für Autobatterien enthält Schwefelsäure. Diese ist besonders gefährlich. Ätzende
Stoffe werden mit dem GHS-Piktogramm „Ätzwirkung“ gekennzeichnet:
Verwendung der Säuren im Haushalt Säuren werden vielfältig in Reinigungsmitteln eingesetzt, zum Beispiel im WC-Reiniger. Ein Entkalker enthält eine Säure, die Kalkreste an Wasserrohren oder in Gefäßen auflöst. Auch hierbei ist das Arbeiten mit Schutzbrille und Schutzhandschuhen vorgeschrieben. Gibt man zum Beispiel verdünnte Salzsäure oder einen Entkalker auf eine kalkhaltige Versteinerung, beginnt es zu schäumen. Das Experiment funktioniert auch mit dem Mineral Calcit, der aus kristallinem Kalk aufgebaut ist. Der Kalk ist chemisch aus Calciumcarbonat aufgebaut. Dieses wird durch Salzsäure aufgelöst, wobei das Gas Kohlenstoffdioxid entsteht. Nachweis der Säuren Säuren kann man in jedem Haushalt ganz einfach nachweisen, wenn man
Essig auf Blaukrautblätter tropft. Sie färben sich dabei rot.
Im
Labor weist man Säuren mit Farbstofflösungen
nach, die mit
Säuren ihre Farbe wechseln. Man nennt solche Nachweisreagenzien pH-Indikatoren. Auch
Blaukraut enthält einen Farbstoff als Indikator. Im Labor setzt man zum Beispiel Lackmus als Indikator ein. Vermischt man eine Säure mit
Wasser, erhält man eine saure Lösung, die sauer schmeckt und
einen Indikator verfärbt.
Der Säurebegriff in der Chemie 1. Säure als Stoff Bei den
Griechen und Römern
war eine Säure ein Stoff, der essigähnliche
Eigenschaften aufwies, sauer schmeckte oder zersetzend auf andere Stoffe
wirkte.
Das lateinische Wort acidus für sauer leitet sich vom lateinischen Wort acetum für Essig ab. Der Alchemist Johann Rudolph
Glauber (1604–1670) stellte viele neue Säuren her, es gelang ihm erstmals die Herstellung konzentrierter Salzsäure
und deren Salze. Salzsäure, Schwefelsäure oder Salpetersäure werden seit langem in jedem Labor verwendet. Der französische Chemiker Antoine
Lavoisier glaubte noch im Jahr 1789, dass Sauerstoff in allen Säuren vorhanden ist. Das Prinzip „oxygène“ sah er
als säureerzeugendes Prinzip im Sauerstoff vorliegen. Humphry
Davy widerlegte Lavoisiers Theorie und zeigte im Jahr 1812, dass
sich vom Chlor kein Sauerstoff abtrennen lässt. Daraus folgerte
er, dass auch die Salzsäure keine sauerstoffhaltige Verbindung sein
kann, sondern dass Wasserstoff das kennzeichnende
Element von Säuren sein muss.
Der heute noch gültige Begriff einer Säure als Stoff geht auf Justus von Liebig zurück. Er bezeichnete um 1838 die Säuren als Stoffe, die chemisch gebundenen Wasserstoff enthalten, der durch Metalle ersetzt werden kann. Die Benennung der Stoffe und Chemikalien geht hauptsächlich auf diese Definition zurück. Mit Metallen oder Metalloxiden bildet eine Säure in wässriger Lösung unter Entwicklung von Wasserstoff ein typisches Salz. Im ersten Beispiel reagiert Natrium mit Salzsäure zu Natriumchlorid und Wasserstoff. Im zweiten Beispiel reagiert Kupfer(II)-oxid mit Salzsäure zu Kupfer(II)-chlorid und Wasser. Unedles Metall + Säure 2 Na + 2 HCl(aq) Metalloxid + Säure CuO + 2 HCl(aq) Bei der Reaktion eines Metalls mit Salzsäure entstehen immer die entsprechenden Chloride. Mit Salpetersäure erhält man die Nitrate, mit Schwefelsäure die Sulfate und mit Phosphorsäure die Phosphate. Mit Laugen reagieren die Säuren in einer Neutralisationsreaktion. Säuren können auch mit Salzen reagieren, wenn die Säure, die mit dem Salz reagiert, stärker ist als die Säure, aus der das Salz gebildet wurde.
2. Säurebegriff nach Arrhenius
Reines Wasser leitet nur ganz wenig Strom. Wenn man Kochsalz dazu schüttet, dann wird die Lösung elektrisch leitfähig. Daraus schlossen die Chemiker, dass in den wässrigen Lösungen der Salze Ionen als Ladungsüberträger vorhanden sein müssen. Wenn man eine Säure mit Wasser vermischt, leitet die Flüssigkeit ebenfalls elektrischen Strom. Der schwedische Chemiker Svante Arrhenius definierte um 1887 die Säuren als Stoffe, die im Wasser Protonen H+ abgeben können und ein Säurerest-Ion bilden. Nach Arrhenius' Säurebegriff enthalten saure Lösungen positiv geladene Protonen und negativ geladene Säurerest-Ionen, alkalische Lösungen dagegen positiv geladene Base-Rest-Ionen und Hydroxid-Ionen. 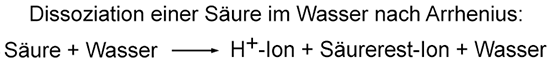 Nach Arrhenius ist die Salzsäure keine Säure mehr, sondern der Chlorwasserstoff, der mit Wasser zur „Salzsäure“ reagiert und die Protonen bildet. Die Definition nach Arrhenius kann nach heutigem Verständnis trotzdem nur unzureichend erklären, was bei der Reaktion einer Säure mit Wasser passiert. H+-Ionen für sich alleine können nicht im Wasser existieren, sie benötigen immer einen Reaktionspartner, von dem sie aufgenommen werden. Auch Arrhenius' Basenbegriff ist unzureichend, da es neben den Hydroxiden auch andere Stoffe gibt, die alkalische Lösungen bilden können. 3. Funktioneller Säurebegriff nach Brønsted (deutsche Aussprache „Brönsted“) 1923 präzisierte der dänische Chemiker Johannes Nicolaus Brønsted (1879–1947) den Säure-Base-Begriff. Nach Brønsted sind Säuren Protonenspender und übertragen diese auf einen Reaktionspartner. Mit Wasser bilden sich Hydronium-Ionen H3O+, die auch Oxonium-Ionen genannt werden. Das folgende Beispiel zeigt, was passiert, wenn sich die Brønsted-Säure Chlorwasserstoff im Wasser löst. Ein Chlorwasserstoff-Molekül überträgt ein Proton an das Wasser-Molekül, das zu einem Hydronium-Ion reagiert. Beim Chlor-Atom bleibt das übrige Elektron des Wasserstoff-Atoms zurück und bildet dadurch einen negativen Ladungsüberschuss. Es wird zu einem negativ geladenen Chlorid-Ion: 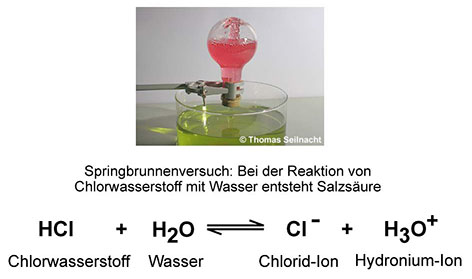 Eine wässrige Lösung,
die Chlorid-Ionen Cl− und Hydronium-Ionen H3O+ enthält,
wird zwar als „Salzsäure“ bezeichnet, doch nach Brønsted ist
der Chlorwasserstoff die eigentliche Säure. Die Brønsted-Base ist das Gegenteil
einer Brønsted-Säure. Brønsted-Basen
übernehmen Protonen von ihren Reaktionspartnern. Daher wirkt das
Wasser in
unserem Beispiel als Brønsted-Base.
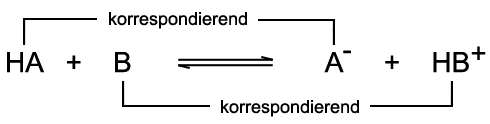 Die Brønsted-Säure HA überträgt ein Proton an die Brønsted-Base B. Die Paare HA/A− und B/HB+ sind korrespondierende Säure-Base-Paare. Der Doppelpfeil verdeutlicht, dass die Reaktion in beide Richtungen abläuft und sich ein chemisches Gleichgewicht einstellt. Zur Verdeutlichung wird die oben beschriebene Säure-Base-Reaktion des Chlorwasserstoffs mit Wasser herangezogen: 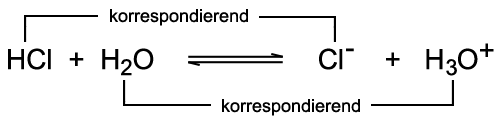 Das Chlorid-Ion Cl− ist die korrespondierende Base zur Säure Chlorwasserstoff HCl. Das Hydronium-Ion H3O+ ist die korrespondierende
Säure zur Base Wasser H2O. Im Wasser selbst kann eine
Protolyse auch ohne einen Reaktionspartner stattfinden, es handelt sich dann
um eine Autoprotolyse.
Säurestärke nach Brønsted Die Stärke einer Säure hängt davon ab, wie gut sie Protonen abgibt und an einen Reaktionspartner überträgt. Starke Säuren wie die Salzsäure oder die Salpetersäure sind fast vollständig protolysiert. Sie übertragen in wässriger Lösung zu fast 100 % ihre Protonen an das Wasser-Molekül unter Bildung der H3O+-Ionen. Eher schwache Säuren wie die Essigsäure reagieren nur teilweise. Bei einer Essigsäurelösung mit der Konzentration 1 Mol pro Liter stellt sich beispielsweise ein Gleichgewicht ein, das noch stark auf der Seite links in der Gleichung liegt. Es haben hierbei nur 0,4% der Essigsäure-Moleküle mit den Wasser-Molekülen reagiert. 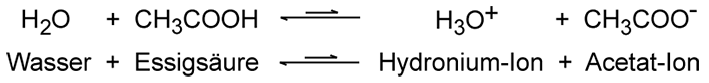 4. Säure-Base-Begriff nach Lewis Der US-amerikanische Chemiker Gilbert Newton Lewis (1875–1946) veröffentlichte eine andere Säure-Basen-Theorie. Nach Lewis können Säuren Elektronenpaare anlagern, sie sind Elektronenpaar-Akzeptoren. Bei einer Säure-Base-Reaktion nach Lewis werden Elektronenpaarbindungen gebildet. Lewis-Säuren sind elektrophile Teilchen, sie sind auf der Suche nach negativer Ladung und haben ein unvollständig besetztes Orbital in der Valenzschale. Nach Lewis kann zum Beispiel auch Aluminiumchlorid AlCl3 als Säure wirken. Entsprechend sind Lewis-Basen nucleophile Teilchen, die auf der Suche nach positiver Ladung sind und Elektronenpaare zur Verfügung stellen können. Sie wirken als Elektronenpaar-Donatoren. Wasser-, Stickstoff- oder auch die Ammoniak-Moleküle zählen dazu. Im Chemieunterricht wird das Lewis-Model kaum verwendet, da es zu kompliziert ist. Chlorwasserstoff ist nach Lewis zum Beispiel keine Säure mehr, nur das Proton H+ ist eine Säure, da es als Elektronenpaar-Akzeptor wirkt. Das Konzept nach Lewis ist allerdings zum Verständnis der Reaktionsmechanismen in der organischen Chemie unverzichtbar, weil es eine Reihe der Reaktionen dort erklären kann. Weitere Informationen Basen Autoprotolyse (des Wassers) Ätzende Stoffe bei den Gefahrstoffen Powerpoint-Präsentationen zum Thema Buch individuell erstellen: Basis-Text Säuren   > Inhaltsverzeichnis |




