 |
 Farblose, glänzende Blättchen oder weißes, kristallines Pulver Vorkommen Harze und Beeren, Heidelbeeren, Preiselbeeren |
Molmasse 122,122 g/mol AGW 0,5mg/m3 (TRGS 900) Dichte 1,2659 g/cm3 Schmelzpunkt +122,352 °C Siedepunkt +250,2 °C Wasserlöslichkeit Konz. bei 25 °C 3,4 g/l Explosionsgrz. min. 15 Vol.-% (Luft) Flammpunkt +121 °C Zündpunkt +570 °C |
| Piktogramme GHS 05 GHS 08 Gefahr |
Gefahrenklassen
+ Kategorie Ätz-/Reizwirkung auf die Haut 2 Schwere Augenschäd./-reizung 1 Spez. Zielorgantoxizität w. Lunge 1 |
HP-Sätze (siehe auch Hinweis) H 315, 318, 372 (Lunge) P 264.1, 280.1-3,7, 302+352, 305+351+338, 314 Entsorgung G 3 |
| Etikett drucken | Deutsche Bezeichnung Synonym (deutsch) |
Engl. Bezeichnung Synonym (engl.) |
| CAS 65-85-0 | Benzoesäure Benzolcarbonsäure |
Benzoic acid Benzene carboxylic acid |
| Eigenschaften Benzoesäure
bildet
farblose, glänzende Blättchen oder
nadelförmige Kristalle. Das kristalline Pulver erscheint
weiß. Es ist in kaltem Wasser nur wenig, in warmem Wasser dagegen
besser löslich. Benzoesäure löset sich auch in
Ethylalkohol, Diethylether
und Aceton. Die einfachste aromatische Carbonsäure ist eine etwas stärkere
Säure als Essigsäure. Die Salze der Benzoesäure werden Benzoate genannt. Die Säure
wirkt stark bakterien- und pilztötend. Sie sublimiert ab 100 °C
unter Abgabe schleimhautreizender Dämpfe. An der Luft ist sie relativ
beständig.
 Beim Erhitzen zersetzt sich Benzoesäure erst oberhalb
von 370 °C in Benzol und Kohlenstoffdioxid. Beim Erhitzen mit Natriumhydroxid
kann man aus Benzoesäure Benzol herstellen (Versuch).
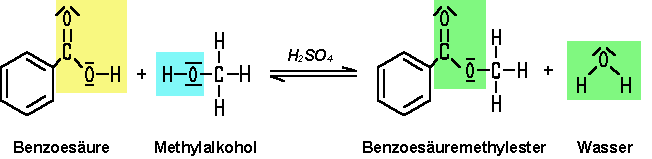
Mit Methylalkohol lässt sich Benzoesäure
bei Gegenwart von konzentrierter Schwefelsäure verestern. Die Benzoesäureester finden eine vielfältige Anwendung
als wohlriechende Aromastoffe in der Parfümindustrie. Viele Veresterungen von Benzoesäure gelingen allerdings erst mit Benzoylchlorid.
 Durch eine Destillation
mit Phosphor(V)-chlorid oder mit Thionylchlorid erhält man das Benzoylchlorid,
eine farblose, stechend riechende Flüssigkeit, die immer dann benötigt
wird, wenn die Benzoylgruppe in Alkohole, Phenole oder Amine eingeführt
werden soll:
 |
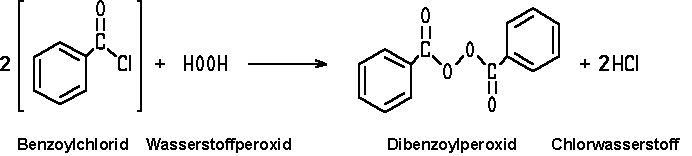
Beim Schütteln von
Benzoylchlorid mit Wasserstoffperoxid bildet
sich Dibenzoylperoxid, ein explosiver Feststoff, der zum Bleichen und vor allem
bei der Herstellung von Kunststoffen als Starter bei Polymerisationen verwendet
wird:
 |
| Herstellung Beim
Erhitzen von Benzoeharz
sublimiert die Benzoesäure und man erhält
die hustenreizenden
Dämpfe. Das Harz stammt von einer Baumart
(Siam-Benzoe und Sumatra-Benzoe),
die in Indonesien beheimatet ist. Im Labor könnte
man die Benzoesäure relativ einfach durch die Oxidation von Benzaldehyd mit Luftsauerstoff darstellen. In der chemischen Industrie erfolgt die
Herstellung durch eine Oxidation von Toluol mit Braunstein und Schwefelsäure in Gegenwart von Mangannaphthenat. Als Oxidationsmittel
würden sich zur Oxidation von Toluol auch Kaliumpermanganat, Salpetersäure oder Chrom(VI)-oxid eignen.
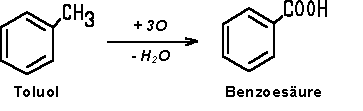 |
| Verwendung Benzoesäure
dient zur Herstellung von Benzoesäureestern
für die Parfümindustrie und für Weichmacher. Sie wird zur
Darstellung
von Benzoylverbindungen wie Benzoylchlorid und Dibenzoylperoxid
benötigt. Sie eignet sich als Konservierungsmittel E210 für
Lebensmittel und kommt in Klebstoffen vor. |