Ethylalkohol, Ethanol
C2H5OH
Ethylalkohol
Ethanol
Ethanol
Ethylic alcohol
Ethanol
Ethanol
Molmasse
AGW
Dichte
Schmelzpunkt
Siedepunkt
Wasserlöslichkeit
Brechungsindex
Explosionsgrenzen
Flammpunkt
Zündpunkt
AGW
Dichte
Schmelzpunkt
Siedepunkt
Wasserlöslichkeit
Brechungsindex
Explosionsgrenzen
Flammpunkt
Zündpunkt
46,068 g/mol
200 ml/m3 (TRGS 900)
0,7893 g/cm3
−114,14 °C
+78,24 °C
vollständig mischbar
1,3611 (bei 20 °C)
3,3 bis 19 Vol.-% (Luft)
+13 °C
+363 °C
200 ml/m3 (TRGS 900)
0,7893 g/cm3
−114,14 °C
+78,24 °C
vollständig mischbar
1,3611 (bei 20 °C)
3,3 bis 19 Vol.-% (Luft)
+13 °C
+363 °C
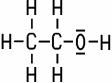
Klare, farblose Flüssigkeit
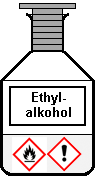
Ethylalkohol ist als Hauptbestandteil im Brennspiritus enthalten (schweizerisch „Brennsprit“). Es handelt sich in beiden Fällen um eine leicht entzündbare Flüssigkeit. Beim Umfüllen werden Dämpfe frei, die zusammen mit Luft eine explosionsfähige Mischung bilden. Offene Flammen oder auch eine versteckte Glut können diese Mischung zünden. Die dabei auftretende Stichflamme oder Verpuffung kann zu schweren Brandverletzungen führen. Brennspiritus darf niemals zum Anfeuern des Holzkohlegrills verwendet werden. Das Erwärmen von Ethylalkohol erfolgt im Labor stets im Wasserbad. Bei der Destillation alkoholhaltiger Getränke im Schullabor ist auf eine gute Raumlüftung zu achten, niemals darf man Alkohol in der Nähe einer Flamme umfüllen. Flaschen und Gefäße werden nach jeder Entnahme sofort verschlossen. Vom Einsatz der veralteten Dochtbrenner ist aufgrund des hohen Gefahrenpotenzials dringend abzuraten: Der Spiritus kann im Reservoir durch die Eigenerhitzung zu sieden beginnen, dann entsteht eine meterhohe Stichflamme. Zum Arbeiten mit Ethylalkohol und Brennspiritus ist das Tragen einer Schutzbrille vorgeschrieben.
Wirkung auf den menschlichen Körper
Reiner, hundertprozentiger Ethylalkohol riecht würzig, schmeckt brennend und wirkt keimtötend. In verdünnter Form wird er in alkoholischen Getränken konsumiert. Bei nicht sorgfältig durchgeführten Gärungen kann neben Ethylalkohol auch der toxische Methylalkohol entstehen. In den käuflichen alkoholischen Getränken dürfte dieser jedoch kaum zu finden sein.

Wird Ethylalkohol über alkoholische Getränke aufgenommen, gelangt er über die Verdauungsorgane in den Blutkreislauf. Da er sowohl fett- als auch wasserlöslich ist, geht er besonders leicht in die fettreichen Gehirn- und Nervenzellen, wo er in geringen Dosen anregend und in hohen Dosen narkoseähnliche Symptome hervorruft. Er wirkt schmerzlindernd und setzt das Reaktionsvermögen herab. Die eigene Leistungsfähigkeit wird überschätzt, deshalb ist Autofahren im Rausch mit großen Risiken verbunden. Besonders gefährlich ist die Einnahme von Alkohol in Verbindung mit Medikamenten. Der länger andauernde Genuss von Alkohol in höheren Konzentrationen kann zu einer Sucht führen. Da Alkohol in Leber und Nieren abgebaut wird, führt er zu schweren Leber- und Nierenschäden. Die Leber verfettet oder die Nieren schrumpfen. Nach neueren, ausführlich belegten Untersuchungen wirkt Ethylalkohol krebserzeugend, neurotoxisch, teratogen und reprotoxisch. [Lit mit umfangreichem Quellenverzeichnis: Bützer in c+b 2/24] Zum Beispiel ist Alkohol ein Verursacher für Bauchspeicheldrüsenkrebs und Brustkrebs, oder er lässt die Nervenzellen im Gehirn absterben.
Alkohol in der Schwangerschaft und Wirkung auf kleinere Kinder
Trinkt eine schwangere Frau auch nur kleine Mengen Alkohol, gelangt dieser zusammen mit seinem toxischen Abbauprodukt Acetaldehyd direkt über die Plazenta zum Fetus. Dieser kann den Alkohol nicht selbst abbauen. Der Alkohol richtet beim ungeborenen Kind verheerende Schäden im Gehirn und in anderen Organen an. Es kann zu Fehlbildungen kommen. Kinder, die mit dem fetalen Alkoholsyndrom (FAS) geboren werden, zeigen nach der Geburt geistige, motorische und verhaltensbezogene Entwicklungsstörungen. Solche Kinder laufen auch später Gefahr, häufiger an der Alkoholsucht zu erkranken. Eine erhebliche Gefahr besteht auch nach der Geburt, wenn Eltern nicht entsprechend informiert sind: Für kleinere Kinder wirken geringe Alkoholmengen – wie sie zum Beispiel in natürlichem Apfelsaft-Konzentrat vorkommen – stark toxisch, da die Leber die zum Abbau notwendigen Enzyme erst nach und nach entwickelt.
Alkohol in Lebensmitteln
Ethylalkohol kommt nicht nur in alkoholischen Getränken, sondern auch in verschiedenen Lebensmitteln in geringen Konzentrationen vor. So kann gewöhnlicher Apfelsaft bis zu drei Gramm pro Liter Alkohol enthalten! Das entspricht etwa 0,38 Volumenprozent. Aber auch in Traubensaft, Sauerkraut, Bananen, Äpfel, Kefir, Joghurt oder Weißbrot ist er enthalten. Als alkoholhaltig gelten Getränke, die mehr als 1,2 Volumenprozent Alkohol enthalten. Ab dieser Konzentration gilt eine generelle Deklarationspflicht des Alkohols für Nahrungsmittel. Ein als „alkoholfrei“ deklariertes Getränk darf dagegen nicht mehr als 0,5 Volumenprozent enthalten.
Chemisch-physikalische Eigenschaften
Ethylalkohol ist eine leicht entzündbare, hygroskopische, stark wasseranziehende Flüssigkeit. Sie verbrennt nach dem Anzünden mit schwach leuchtender Flamme am Luftsauerstoff zu Kohlenstoffdioxid und Wasserdampf. Die Flamme leuchtet deutlich mehr als die Flamme, die beim Verbrennen von Methylalkohol entsteht:

Flammen beim Verbrennen von Methylalkohol (links) und Ethylalkohol (rechts).
Der Alkohol ist gut wasserlöslich und löst auch die meisten anderen organischen Lösungsmittel wie Diethylether, Benzin, Benzol oder Chloroform. Bei der Mischung mit Wasser kommt es zur Volumenkontraktion und einer Wärmeentwicklung. 52 Volumenteile Ethylalkohol und 48 Volumenteile Wasser ergeben nicht 100, sondern nur 96,3 Volumenteile der Mischung.
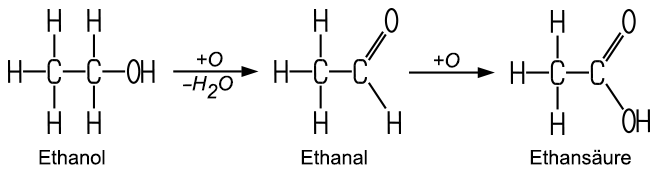
Die ungefähre Dichtebestimmung erfolgt nach der Schwebe-Methode mit einem Aräometer. Die relativ exakte Messung kann im Labor mit einem Pyknometer vorgenommen werden. Ethanol-Wasser-Gemische sind über einer Gewichtskonzentration von etwa 40 % brennbar, das entspricht etwa 47 Volumenprozent. Bei der Oxidation des Ethylalkohols, beispielsweise mit Kupferoxid, erhält man Ethanal, das erneut oxidiert werden kann, wobei Ethansäure entsteht. Diese Säure ist auch unter dem Namen Essigsäure bekannt:
Steht Wein längere Zeit offen an der Luft, schmeckt er nach einiger Zeit sauer. Warum ist das so? Der Ethanol oxidiert in einer enzymatischen Reaktion mit Hilfe von Essigsäurebakterien in zwei Schritten zu Ethansäure. Diese Bakterien sind im Wein und auch in der Luft vorhanden.
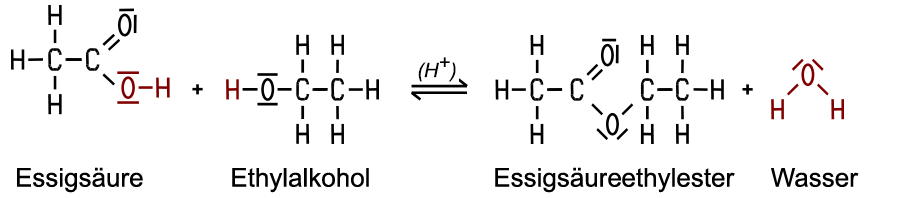
Mit Alkansäuren und beim Vorliegen von Wärme und eines Katalysators wie Schwefelsäure entstehen geruchsintensive Esterverbindungen. Bei der Reaktion mit Essigsäure erhält man Essigsäureethylester. Diese hier nur summarisch dargestellte Ester-Reaktion ist ein Reaktionsmechanismus mit mehreren Zwischenschritten, wobei zum Schluss Wasser abgespalten wird und der Ester entsteht:
Erhitzt man Ethanol im Überschuss in Gegenwart von konzentrierter Schwefelsäure auf etwa 140 °C, entsteht Diethylether. Zuerst wird das Ethanol-Molekül protoniert, was die Voraussetzung für eine Wasserabspaltung darstellt. Ein zweites Ethanol-Molekül greift nukleophil am Kohlenstoff-Atom an, wobei Wasser abgespalten wird. Nach der Wasserabspaltung wird das Proton wieder abgegeben, so dass die konzentrierte Schwefelsäure als Katalysator erhalten bleibt. Die Meerweinreaktion ist eine säurekatalysierte Kondensationsreaktion. In der Gesamtreaktion entstehen aus zwei Ethanol-Molekülen ein Diethylether-Molekül und ein Wasser-Molekül, das abgespalten wird:
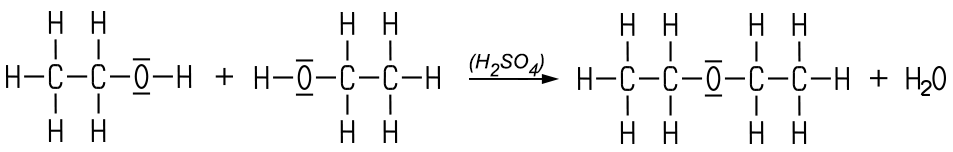
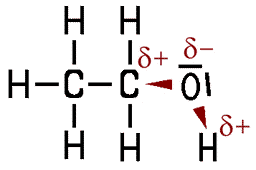
Polarität des Ethanol-Moleküls
Ethanol ist vollständig mit Wasser mischbar, die Wasserlöslichkeit ist ausgezeichnet. Erklären lässt sich das anhand des Molekülbaus. Das Ethanol-Molekül enthält eine Hydroxy-Gruppe (OH-Gruppe). Das stark elektronegative Sauerstoff-Atom zieht die Bindungselektronen der Elektronenpaarbindung stärker an und trägt daher eine partielle negative Ladung (δ−). Dadurch ergibt sich eine unterschiedliche Elektronendichte im Ethanol-Molekül, das Molekül ist polar, es ist ein Dipol.
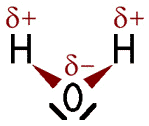
Ethanol-Molekül (links) und Wasser-Molekül (rechts).
Das Wasser-Molekül ist ebenfalls ein Dipol. Nähert sich ein Ethanol-Molekül einem Wasser-Molekül, ziehen sich die gegensätzlichen Ladungen gegenseitig an. Die zwischenmolekulare Anziehungskraft zwischen einem partiell positiv geladenen Wasserstoff-Atom und einem freien Elektronenpaar eines partiell negativ geladenen Sauerstoff-Atoms wird als Wasserstoffbrückenbindung bezeichnet. Diese wird mit einer gestrichelten Linie dargestellt. Zwischen einem Ethanol-Molekül und einem Wasser-Molekül können sich maximal zwei Wasserstoffbrückenbindungen bilden:

Wasserstoffbrückenbindungen zwischen den beiden Molekülen.
Aus diesem Grund sind Ethanol und auch Methanol sehr gut wasserlöslich. Im Gegensatz zum Methanol besitzt Ethanol schon eine kurze Kohlenstoffkette. Mit zunehmender Länge des Kohlenwasserstoffrests nimmt die Wasserlöslichkeit ab. Der kurze Alkyl-Rest des Ethanol-Moleküls ist unpolar. Mit zunehmender Länge des Alkyl-Rests nimmt der unpolare Anteil im Verhältnis zum polaren Anteil im Molekül zu, so dass die Wechselwirkungen mit den Wasser-Molekülen gestört werden. Die Van-der-Waals-Kräfte zwischen den größeren Molekülen verstärken den Effekt, allerdings nur zu einem relativ geringen Anteil. Deshalb ist Butanol deutlich weniger wasserlöslich und dafür umso besser benzinlöslich. Die noch kurze Kohlenstoffkette des Ethanol-Moleküls ermöglicht zusätzlich eine begrenzte Benzinlöslichkeit.
Reiner, hundertprozentiger Ethylalkohol riecht würzig, schmeckt brennend und wirkt keimtötend. In verdünnter Form wird er in alkoholischen Getränken konsumiert. Bei nicht sorgfältig durchgeführten Gärungen kann neben Ethylalkohol auch der toxische Methylalkohol entstehen. In den käuflichen alkoholischen Getränken dürfte dieser jedoch kaum zu finden sein.
Wird Ethylalkohol über alkoholische Getränke aufgenommen, gelangt er über die Verdauungsorgane in den Blutkreislauf. Da er sowohl fett- als auch wasserlöslich ist, geht er besonders leicht in die fettreichen Gehirn- und Nervenzellen, wo er in geringen Dosen anregend und in hohen Dosen narkoseähnliche Symptome hervorruft. Er wirkt schmerzlindernd und setzt das Reaktionsvermögen herab. Die eigene Leistungsfähigkeit wird überschätzt, deshalb ist Autofahren im Rausch mit großen Risiken verbunden. Besonders gefährlich ist die Einnahme von Alkohol in Verbindung mit Medikamenten. Der länger andauernde Genuss von Alkohol in höheren Konzentrationen kann zu einer Sucht führen. Da Alkohol in Leber und Nieren abgebaut wird, führt er zu schweren Leber- und Nierenschäden. Die Leber verfettet oder die Nieren schrumpfen. Nach neueren, ausführlich belegten Untersuchungen wirkt Ethylalkohol krebserzeugend, neurotoxisch, teratogen und reprotoxisch. [Lit mit umfangreichem Quellenverzeichnis: Bützer in c+b 2/24] Zum Beispiel ist Alkohol ein Verursacher für Bauchspeicheldrüsenkrebs und Brustkrebs, oder er lässt die Nervenzellen im Gehirn absterben.
Alkohol in der Schwangerschaft und Wirkung auf kleinere Kinder
Trinkt eine schwangere Frau auch nur kleine Mengen Alkohol, gelangt dieser zusammen mit seinem toxischen Abbauprodukt Acetaldehyd direkt über die Plazenta zum Fetus. Dieser kann den Alkohol nicht selbst abbauen. Der Alkohol richtet beim ungeborenen Kind verheerende Schäden im Gehirn und in anderen Organen an. Es kann zu Fehlbildungen kommen. Kinder, die mit dem fetalen Alkoholsyndrom (FAS) geboren werden, zeigen nach der Geburt geistige, motorische und verhaltensbezogene Entwicklungsstörungen. Solche Kinder laufen auch später Gefahr, häufiger an der Alkoholsucht zu erkranken. Eine erhebliche Gefahr besteht auch nach der Geburt, wenn Eltern nicht entsprechend informiert sind: Für kleinere Kinder wirken geringe Alkoholmengen – wie sie zum Beispiel in natürlichem Apfelsaft-Konzentrat vorkommen – stark toxisch, da die Leber die zum Abbau notwendigen Enzyme erst nach und nach entwickelt.
Alkohol in Lebensmitteln
Ethylalkohol kommt nicht nur in alkoholischen Getränken, sondern auch in verschiedenen Lebensmitteln in geringen Konzentrationen vor. So kann gewöhnlicher Apfelsaft bis zu drei Gramm pro Liter Alkohol enthalten! Das entspricht etwa 0,38 Volumenprozent. Aber auch in Traubensaft, Sauerkraut, Bananen, Äpfel, Kefir, Joghurt oder Weißbrot ist er enthalten. Als alkoholhaltig gelten Getränke, die mehr als 1,2 Volumenprozent Alkohol enthalten. Ab dieser Konzentration gilt eine generelle Deklarationspflicht des Alkohols für Nahrungsmittel. Ein als „alkoholfrei“ deklariertes Getränk darf dagegen nicht mehr als 0,5 Volumenprozent enthalten.
| Nahrungsmittel | Alkoholgehalt ca. Volumenprozent |
Genussmittel | Alkoholgehalt ca. Volumenprozent |
| Brot | 0 bis 0,3 % | Bier Export/Pils | 4,5 bis 6 % |
| Apfelsaft | 0 bis 0,4 % | Starkbier | 6 bis 12 % |
| Alkoholfreies Bier | 0 bis 0,5 % | Most | 4 bis 8 % |
| Sauerkraut | 0 bis 0,5 % | Wein/Sekt | 8 bis 14 % |
| Traubensaft | 0 bis 0,6 % | Likör | 15 bis 40 % |
| Bananen, Äpfel | 0 bis 1 % | Branntwein | 37,5 bis 80 % |
| Kefir, Joghurt | 0 bis 1 % | Rum | 60 bis 80 % |
Chemisch-physikalische Eigenschaften
Ethylalkohol ist eine leicht entzündbare, hygroskopische, stark wasseranziehende Flüssigkeit. Sie verbrennt nach dem Anzünden mit schwach leuchtender Flamme am Luftsauerstoff zu Kohlenstoffdioxid und Wasserdampf. Die Flamme leuchtet deutlich mehr als die Flamme, die beim Verbrennen von Methylalkohol entsteht:

Flammen beim Verbrennen von Methylalkohol (links) und Ethylalkohol (rechts).
Der Alkohol ist gut wasserlöslich und löst auch die meisten anderen organischen Lösungsmittel wie Diethylether, Benzin, Benzol oder Chloroform. Bei der Mischung mit Wasser kommt es zur Volumenkontraktion und einer Wärmeentwicklung. 52 Volumenteile Ethylalkohol und 48 Volumenteile Wasser ergeben nicht 100, sondern nur 96,3 Volumenteile der Mischung.
Dichte in Gramm pro Kubikzentimeter bei 20 °C |
Volumenprozent Ethanol | Dichte in Gramm pro Kubikzentimeter bei 20 °C |
Gewichtsprozent Ethanol |
|
| 0,9847 |
10 |
0,9818 |
10 |
|
| 0,9736 |
20 |
0,9686 |
20 |
|
| 0,9622 |
30 |
0,9538 |
30 |
|
| 0,9480 |
40 |
0,9352 |
40 |
|
| 0,9301 |
50 |
0,9138 |
50 |
|
| 0,9091 |
60 |
0,8911 |
60 |
|
| 0,8856 |
70 |
0,8676 |
70 |
|
| 0,8593 |
80 |
0,8434 |
80 |
|
| 0,8292 |
90 |
0,8180 |
90 |
|
| 0,7893 | 100 |
0,7893 |
100 |
Dichte von Ethanol-Wasser-Gemischen bei 20 °C, Quellen: Volumenprozent Katmar Software, Gewichtsprozent gerundet nach Lide
Die ungefähre Dichtebestimmung erfolgt nach der Schwebe-Methode mit einem Aräometer. Die relativ exakte Messung kann im Labor mit einem Pyknometer vorgenommen werden. Ethanol-Wasser-Gemische sind über einer Gewichtskonzentration von etwa 40 % brennbar, das entspricht etwa 47 Volumenprozent. Bei der Oxidation des Ethylalkohols, beispielsweise mit Kupferoxid, erhält man Ethanal, das erneut oxidiert werden kann, wobei Ethansäure entsteht. Diese Säure ist auch unter dem Namen Essigsäure bekannt:

Steht Wein längere Zeit offen an der Luft, schmeckt er nach einiger Zeit sauer. Warum ist das so? Der Ethanol oxidiert in einer enzymatischen Reaktion mit Hilfe von Essigsäurebakterien in zwei Schritten zu Ethansäure. Diese Bakterien sind im Wein und auch in der Luft vorhanden.
Mit Alkansäuren und beim Vorliegen von Wärme und eines Katalysators wie Schwefelsäure entstehen geruchsintensive Esterverbindungen. Bei der Reaktion mit Essigsäure erhält man Essigsäureethylester. Diese hier nur summarisch dargestellte Ester-Reaktion ist ein Reaktionsmechanismus mit mehreren Zwischenschritten, wobei zum Schluss Wasser abgespalten wird und der Ester entsteht:

Erhitzt man Ethanol im Überschuss in Gegenwart von konzentrierter Schwefelsäure auf etwa 140 °C, entsteht Diethylether. Zuerst wird das Ethanol-Molekül protoniert, was die Voraussetzung für eine Wasserabspaltung darstellt. Ein zweites Ethanol-Molekül greift nukleophil am Kohlenstoff-Atom an, wobei Wasser abgespalten wird. Nach der Wasserabspaltung wird das Proton wieder abgegeben, so dass die konzentrierte Schwefelsäure als Katalysator erhalten bleibt. Die Meerweinreaktion ist eine säurekatalysierte Kondensationsreaktion. In der Gesamtreaktion entstehen aus zwei Ethanol-Molekülen ein Diethylether-Molekül und ein Wasser-Molekül, das abgespalten wird:
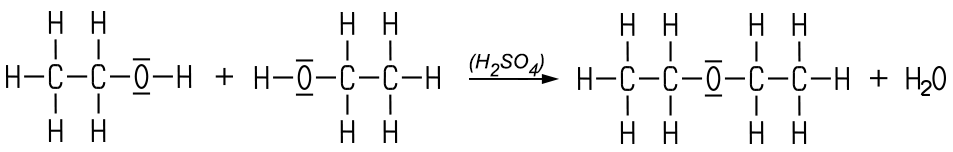
Polarität des Ethanol-Moleküls
Ethanol ist vollständig mit Wasser mischbar, die Wasserlöslichkeit ist ausgezeichnet. Erklären lässt sich das anhand des Molekülbaus. Das Ethanol-Molekül enthält eine Hydroxy-Gruppe (OH-Gruppe). Das stark elektronegative Sauerstoff-Atom zieht die Bindungselektronen der Elektronenpaarbindung stärker an und trägt daher eine partielle negative Ladung (δ−). Dadurch ergibt sich eine unterschiedliche Elektronendichte im Ethanol-Molekül, das Molekül ist polar, es ist ein Dipol.


Ethanol-Molekül (links) und Wasser-Molekül (rechts).
Das Wasser-Molekül ist ebenfalls ein Dipol. Nähert sich ein Ethanol-Molekül einem Wasser-Molekül, ziehen sich die gegensätzlichen Ladungen gegenseitig an. Die zwischenmolekulare Anziehungskraft zwischen einem partiell positiv geladenen Wasserstoff-Atom und einem freien Elektronenpaar eines partiell negativ geladenen Sauerstoff-Atoms wird als Wasserstoffbrückenbindung bezeichnet. Diese wird mit einer gestrichelten Linie dargestellt. Zwischen einem Ethanol-Molekül und einem Wasser-Molekül können sich maximal zwei Wasserstoffbrückenbindungen bilden:

Wasserstoffbrückenbindungen zwischen den beiden Molekülen.
Aus diesem Grund sind Ethanol und auch Methanol sehr gut wasserlöslich. Im Gegensatz zum Methanol besitzt Ethanol schon eine kurze Kohlenstoffkette. Mit zunehmender Länge des Kohlenwasserstoffrests nimmt die Wasserlöslichkeit ab. Der kurze Alkyl-Rest des Ethanol-Moleküls ist unpolar. Mit zunehmender Länge des Alkyl-Rests nimmt der unpolare Anteil im Verhältnis zum polaren Anteil im Molekül zu, so dass die Wechselwirkungen mit den Wasser-Molekülen gestört werden. Die Van-der-Waals-Kräfte zwischen den größeren Molekülen verstärken den Effekt, allerdings nur zu einem relativ geringen Anteil. Deshalb ist Butanol deutlich weniger wasserlöslich und dafür umso besser benzinlöslich. Die noch kurze Kohlenstoffkette des Ethanol-Moleküls ermöglicht zusätzlich eine begrenzte Benzinlöslichkeit.
Bei der alkoholischen Gärung werden vorwiegend Einfachzucker wie Glucose oder Fructose – zum Beispiel aus Trauben, Beeren oder Obst – in Gegenwart von Hefepilzen zu Ethanol und Kohlenstoffdioxid abgebaut. Die Hefepilze wirken als Enzyme und ermöglichen den biochemischen Gärungsprozess:

 Beim Bierbrauen wird Getreidestärke zunächst zu Malzzucker
Beim Bierbrauen wird Getreidestärke zunächst zu Malzzucker
umgewandelt, der danach im Gärungsprozess Alkohol bildet.
Das entstehende Alkoholerzeugnis besitzt eine maximale Alkoholkonzentration von 18 Prozent, da die Hefezellen oberhalb dieser Konzentration zugrunde gehen. Durch nachfolgendes mehrfaches Destillieren, dem sogenannten „Schnapsbrennen“, erhält man ein azeotropes Alkohol-Wasser-Gemisch mit etwa 95 Prozent Alkoholgehalt. Durch eine erneute Destillation und Zugabe eines wasserentziehenden Stoffes, zum Beispiel geglühtes, weißes Kupfersulfat oder gebrannter Kalk, ist ein reiner, wasserfreier Alkohol zugänglich.

 Beim „Schnapsbrennen“ wird aus einem alkoholhaltigen Getränk
Beim „Schnapsbrennen“ wird aus einem alkoholhaltigen Getränk
Alkohol abdestilliert. Man erhält ein hochprozentiges Getränk.
Industriell kann Ethylalkohol künstlich durch eine Hydratisierung aus Ethen hergestellt werden. Diese Reaktion findet unter Hitze, hohem Druck und mit Hilfe von Phosphorsäure statt:

Glucose  Ethanol + Kohlenstoffdioxid
Ethanol + Kohlenstoffdioxid
umgewandelt, der danach im Gärungsprozess Alkohol bildet.
Das entstehende Alkoholerzeugnis besitzt eine maximale Alkoholkonzentration von 18 Prozent, da die Hefezellen oberhalb dieser Konzentration zugrunde gehen. Durch nachfolgendes mehrfaches Destillieren, dem sogenannten „Schnapsbrennen“, erhält man ein azeotropes Alkohol-Wasser-Gemisch mit etwa 95 Prozent Alkoholgehalt. Durch eine erneute Destillation und Zugabe eines wasserentziehenden Stoffes, zum Beispiel geglühtes, weißes Kupfersulfat oder gebrannter Kalk, ist ein reiner, wasserfreier Alkohol zugänglich.
Alkohol abdestilliert. Man erhält ein hochprozentiges Getränk.
Industriell kann Ethylalkohol künstlich durch eine Hydratisierung aus Ethen hergestellt werden. Diese Reaktion findet unter Hitze, hohem Druck und mit Hilfe von Phosphorsäure statt:

Ethylalkohol ist ein weit verbreitetes Genussmittel in alkoholischen Getränken. In der Medizin und der Pharmazie wird er als Extraktionsmittel, für Tinkturen und als Desinfektionsmittel verwendet. In den heutigen Thermometern mit roter Füllung befindet sich ein angefärbtes Alkoholgemisch als Ersatz für das giftige Quecksilber.

 Thermometer mit gefärbter, alkoholischer Füllung im Joghurt (links),
Thermometer mit gefärbter, alkoholischer Füllung im Joghurt (links),
alkoholische Arnika-Extrakte mit (rechts).
In der Farben- und Lackindustrie ist Ethylalkohol ein universelles Lösungsmittel für Fette, Öle und Harze. Bei kosmetischen Produkten stellt er ein wichtiges Lösungsmittel für Duftstoffe, beispielsweise in Parfüms, Rasierwasser und Haarwasser dar. Im Brennspiritus wird der Ethlylalkohol mit einem Vergällungsmittel ungenießbar gemacht. Die teilweise giftigen Zusatzstoffe enthalten beispielsweise Aceton oder Methanol, Brennspiritus darf daher nicht getrunken werden. Die Spiritusbrenner im Haushalt für Fondue sind heute weitgehend durch Brenner mit einer Brennpaste ersetzt. Die aus Ethylalkohol hergestellte, gelartige Brennpaste gilt als handhabungssicher. Sie wird aus Ethylalkohol und Calciumacetat hergestellt. Vergällter Brennsprit dient auch als Reinigungsmittel zum Putzen von Fenstern.
Der in der Schweiz an verschiedenen Tankstellen erhältliche Bioethanol E85 ist ein Gemisch aus 85 Prozent Ethanol und 15 Prozent bleifreiem Benzin. Dieser Ethanol wird aus nachwachsenden Rohstoffen durch Gärung gewonnen, in der Schweiz hauptsächlich aus Bioabfällen oder Abfällen der Holzindustrie. Bioethanol E85 darf nur in speziellen Fahrzeugmotoren verwendet werden.
Der in Deutschland und in der EU eingeführte Biokraftstoff E10 enthält als Zumischung zum gewöhnlichen Benzin bis zu zehn Prozent Ethanol, der aus Pflanzen gewonnen wird. Bei der Einführung an den Tankstellen stellte sich heraus, dass der Biokraftstoff, trotz der hohen Octanzahl ROZ=95 von vielen Autofahrern nicht angenommen wurde. Einige wenige ältere Fahrzeuge vertragen den Biokraftstoff nicht. Entsprechende Listen zur E10-Verträglichkeit von Kraftfahrzeugen sind beispielsweise beim Verband der deutschen Automobilindustrie erhältlich.
Im Zweiten Weltkrieg diente der Ethylalkohol in Verbindung mit flüssigem Sauerstoff in der V2-Rakete als Raketentreibstoff. Heute ist Ethanol in der chemischen Industrie ein Ausgangsstoff für viele Chemikalien, zum Beispiel für Diethylether, Chloroform, Ethylchlorid, Farbstoffe und Medikamente.
Weitere Infos und Medien
Destillieren als chemische Grundoperation
Schülerübung: Destillieren von Wein
Arbeiten mit Brennspiritus im Haushalt (inklusive Videos)
Digitale Folien zur Destillation und zum Alkohol
Schülerübungen zu den Alkoholen
Alkohole als Stoffgruppe in der organischen Chemie
Infos über Gärungsprozesse
Sauerstoff-Atome im Alkohol-Molekül nachweisen
alkoholische Arnika-Extrakte mit (rechts).
In der Farben- und Lackindustrie ist Ethylalkohol ein universelles Lösungsmittel für Fette, Öle und Harze. Bei kosmetischen Produkten stellt er ein wichtiges Lösungsmittel für Duftstoffe, beispielsweise in Parfüms, Rasierwasser und Haarwasser dar. Im Brennspiritus wird der Ethlylalkohol mit einem Vergällungsmittel ungenießbar gemacht. Die teilweise giftigen Zusatzstoffe enthalten beispielsweise Aceton oder Methanol, Brennspiritus darf daher nicht getrunken werden. Die Spiritusbrenner im Haushalt für Fondue sind heute weitgehend durch Brenner mit einer Brennpaste ersetzt. Die aus Ethylalkohol hergestellte, gelartige Brennpaste gilt als handhabungssicher. Sie wird aus Ethylalkohol und Calciumacetat hergestellt. Vergällter Brennsprit dient auch als Reinigungsmittel zum Putzen von Fenstern.
Der in der Schweiz an verschiedenen Tankstellen erhältliche Bioethanol E85 ist ein Gemisch aus 85 Prozent Ethanol und 15 Prozent bleifreiem Benzin. Dieser Ethanol wird aus nachwachsenden Rohstoffen durch Gärung gewonnen, in der Schweiz hauptsächlich aus Bioabfällen oder Abfällen der Holzindustrie. Bioethanol E85 darf nur in speziellen Fahrzeugmotoren verwendet werden.
Der in Deutschland und in der EU eingeführte Biokraftstoff E10 enthält als Zumischung zum gewöhnlichen Benzin bis zu zehn Prozent Ethanol, der aus Pflanzen gewonnen wird. Bei der Einführung an den Tankstellen stellte sich heraus, dass der Biokraftstoff, trotz der hohen Octanzahl ROZ=95 von vielen Autofahrern nicht angenommen wurde. Einige wenige ältere Fahrzeuge vertragen den Biokraftstoff nicht. Entsprechende Listen zur E10-Verträglichkeit von Kraftfahrzeugen sind beispielsweise beim Verband der deutschen Automobilindustrie erhältlich.
Im Zweiten Weltkrieg diente der Ethylalkohol in Verbindung mit flüssigem Sauerstoff in der V2-Rakete als Raketentreibstoff. Heute ist Ethanol in der chemischen Industrie ein Ausgangsstoff für viele Chemikalien, zum Beispiel für Diethylether, Chloroform, Ethylchlorid, Farbstoffe und Medikamente.
Weitere Infos und Medien
Destillieren als chemische Grundoperation
Schülerübung: Destillieren von Wein
Arbeiten mit Brennspiritus im Haushalt (inklusive Videos)
Digitale Folien zur Destillation und zum Alkohol
Schülerübungen zu den Alkoholen
Alkohole als Stoffgruppe in der organischen Chemie
Infos über Gärungsprozesse
Sauerstoff-Atome im Alkohol-Molekül nachweisen