Gasflaschen mit Ammoniak an Schulen nicht aufbewahren! Zur Demonstration der Eigenschaften kann man das Gas durch Erhitzen aus konzentrierter Ammoniaklösung austreiben. Dabei muss im Abzug gearbeitet werden. Schutzbrille und Schutzhandschuhe müssen angezogen werden. Der Springbrunnenversuch selbst ist im Fachraum als Demoversuch bei guter Lüftung möglich, da mit einer geschlossenen Apparatur gearbeitet wird. Da ein kurzzeitiges Vakuum auftritt, müssen auch die Zuschauer Schutzbrillen tragen, oder es wird eine Schutzscheibe eingesetzt.
Gefährdungsbeurteilung Deutschland (auch EU)
GBU Arbeiten mit Ammoniak: Springbrunnenversuch
Sicherheitsbetrachtung Schweiz
SB Arbeiten mit Ammoniak: Springbrunnenversuch
Ammoniak
NH3
CAS 7664-41-7
Ammoniak
Ammonia
17,031 g/mol
20 ml/m³ A oder 14 mg/m³ (TRGS 900)
0,7714 g/l (Gas, 0 °C, 1013 hPa) (NH3 zu Luft = 0,6)
−77,65 °C
−33,33 °C
Konz. bei 20°C 541 g/l
16 bis 25 Vol.-% (Luft)
+630 °C
20 ml/m³ A oder 14 mg/m³ (TRGS 900)
0,7714 g/l (Gas, 0 °C, 1013 hPa) (NH3 zu Luft = 0,6)
−77,65 °C
−33,33 °C
Konz. bei 20°C 541 g/l
16 bis 25 Vol.-% (Luft)
+630 °C
Farbloses, stechend riechendes Gas

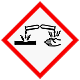


Gefahrenklassen + Kategorie
Entzündbare Gase 2
Gase unter Druck, verdicht. Gas
Akute Toxizität inhalativ 3
Ätz/Reizwirkung auf die Haut 1B
Gewässergefährdend akut 1
Entzündbare Gase 2
Gase unter Druck, verdicht. Gas
Akute Toxizität inhalativ 3
Ätz/Reizwirkung auf die Haut 1B
Gewässergefährdend akut 1
Wirkung auf den menschlichen Körper
Die Angaben in der Literatur zur Geruchsschwelle bis zur tödlichen Dosis variieren stark. Dies hängt wohl auch damit zusammen, dass die Wirkung von Ammoniak je nach Person unterschiedlich ausfällt. Aufgrund der vorliegenden Literatur und eigener Experimente dürfte die Geruchsschwelle zwischen 0,1 ppm und 3 ppm liegen. Ab etwa 100 ppm bis 200 ppm können Reizungen der Schleimhäute und der Augen auftreten. Am Anfang wird die gesamte aufgenommene Menge Ammoniak von der Flüssigkeit in der Nasen- und Mundschleimhaut resorbiert. Die Nase fühlt sich trocken an, Schleimhäute und Augen werden gereizt. Noch höhere Konzentrationen greifen die oberen Atemwege an und lösen Husten, Atembeschwerden oder Brechreiz aus. Bei Allergikern und Asthmatikern tritt diese Wirkung schon bei geringeren Konzentrationen auf. Ab 1700 ppm besteht Lebensgefahr [Lit. Gestis, 2013], eine tödliche Wirkung tritt bei 2000 ppm [Lit. Daunderer 1987] bis 5000 ppm [LCLo-Wert, Lit. ChemIdPlus, 2013] auf. Durch das kurzzeitige Eintamen hoher Konzentrationen kann es zu Entzündungen in den Atemwegen oder zu einem Lungenödem kommen. Dann besteht akute Lebensgefahr. Die Aufnahme von Ammoniaklösung in den Magen verursacht Magenblutungen und Kreislaufkollaps.
Chemisch-physikalische Eigenschaften
Ammoniak ist ein farbloses, stechend riechendes Gas. Es ist in Wasser extrem gut löslich, bei 20 °C lösen sich 520 Liter Gas in einem Liter Wasser. Die Lösung des Gases in Wasser nennt man Ammoniaklösung oder Salmiakgeist. Mit Säuren verbindet sich Ammoniak zu Ammoniumsalzen, beim Zusammentreffen mit Chlorwasserstoff bildet sich in einer Neutralisation ein weißer Ammoniumchlorid-Rauch.
Bei Zimmertemperatur ist das Gas relativ beständig. Bei höheren Temperaturen unter dem Einfluss von Katalysatoren oder bei der Einwirkung von UV-Licht oder einer elektrischen Funkenentladung zerfällt Ammoniak in Stickstoff und Wasserstoff:
Ammoniak-Luftgemische sind innerhalb der Explosionsgrenzen explosiv. Bei höheren Temperaturen lässt sich Ammoniak verbrennen:
Mit Salpetersäure entsteht Ammoniumnitrat:
Die Angaben in der Literatur zur Geruchsschwelle bis zur tödlichen Dosis variieren stark. Dies hängt wohl auch damit zusammen, dass die Wirkung von Ammoniak je nach Person unterschiedlich ausfällt. Aufgrund der vorliegenden Literatur und eigener Experimente dürfte die Geruchsschwelle zwischen 0,1 ppm und 3 ppm liegen. Ab etwa 100 ppm bis 200 ppm können Reizungen der Schleimhäute und der Augen auftreten. Am Anfang wird die gesamte aufgenommene Menge Ammoniak von der Flüssigkeit in der Nasen- und Mundschleimhaut resorbiert. Die Nase fühlt sich trocken an, Schleimhäute und Augen werden gereizt. Noch höhere Konzentrationen greifen die oberen Atemwege an und lösen Husten, Atembeschwerden oder Brechreiz aus. Bei Allergikern und Asthmatikern tritt diese Wirkung schon bei geringeren Konzentrationen auf. Ab 1700 ppm besteht Lebensgefahr [Lit. Gestis, 2013], eine tödliche Wirkung tritt bei 2000 ppm [Lit. Daunderer 1987] bis 5000 ppm [LCLo-Wert, Lit. ChemIdPlus, 2013] auf. Durch das kurzzeitige Eintamen hoher Konzentrationen kann es zu Entzündungen in den Atemwegen oder zu einem Lungenödem kommen. Dann besteht akute Lebensgefahr. Die Aufnahme von Ammoniaklösung in den Magen verursacht Magenblutungen und Kreislaufkollaps.
Chemisch-physikalische Eigenschaften
Ammoniak ist ein farbloses, stechend riechendes Gas. Es ist in Wasser extrem gut löslich, bei 20 °C lösen sich 520 Liter Gas in einem Liter Wasser. Die Lösung des Gases in Wasser nennt man Ammoniaklösung oder Salmiakgeist. Mit Säuren verbindet sich Ammoniak zu Ammoniumsalzen, beim Zusammentreffen mit Chlorwasserstoff bildet sich in einer Neutralisation ein weißer Ammoniumchlorid-Rauch.
NH3 + HCl  NH4Cl
NH4Cl
Bei Zimmertemperatur ist das Gas relativ beständig. Bei höheren Temperaturen unter dem Einfluss von Katalysatoren oder bei der Einwirkung von UV-Licht oder einer elektrischen Funkenentladung zerfällt Ammoniak in Stickstoff und Wasserstoff:
2 NH3  N2 + 3 H2 ΔHR = +92 kJ/mol
N2 + 3 H2 ΔHR = +92 kJ/mol
Ammoniak-Luftgemische sind innerhalb der Explosionsgrenzen explosiv. Bei höheren Temperaturen lässt sich Ammoniak verbrennen:
4 NH3 + 3 O2  2 N2 + 6 H2O ΔHR = −1532 kJ/mol
2 N2 + 6 H2O ΔHR = −1532 kJ/mol
Mit Salpetersäure entsteht Ammoniumnitrat:
HNO3 + NH3  NH4NO3
NH4NO3
Schon die alten Ägypter erzeugten Salmiak durch Fäulnisprozesse von stickstoffhaltigen, organischen Abfällen wie Urin oder Tiermist. 1727 erhielt Stephen Hales (1677–1771) das gasförmige Ammoniak durch Erhitzen eines Gemisches aus Kalk und Salmiak. Carl Wilhelm Scheele (1742–1786) und Humphry Davy (1778–1829) waren an der Ermittlung der chemischen Zusammensetzung beteiligt. In der zweiten Hälfte des 19. Jahrhunderts fiel Ammoniak in der Industrie als Nebenprodukt im Waschwasser bei der Kohlevergasung an. 1898 entdeckte F. Rothe das Herstellungsverfahren nach dem Kalkstickstoff-Prozess. Aus Calciumcarbid und Stickstoff bildete sich zunächst Kalkstickstoff (Calciumcyanamid, CaCN2), der sich beim Erhitzen mit Wasserdampf zu Calciumcarbonat und Ammoniak und zersetzte. Das sogenannte Rothe-Frank-Caro-Verfahren ermöglichte erstmals die industrielle Erzeugung von Ammoniak:
1900 meldete Wilhelm Ostwald (1853–1932) ein Patent zur „Herstellung von Ammoniak und Ammoniakverbindungen aus freiem Stickstoff und Wasserstoff" an. Im Labormaßstab gelang es ihm durch "geeignete Kontaktsubstanzen oder Katalysatoren bereits bei geringer Erhitzung auf 250 bis 300 °C“ Ammoniak herzustellen. In der gleichen Patentschrift empfahl er die Durchführung unter hohem Druck, „da die verhältnismäßige Menge des Ammoniaks im Gasgemisch mit steigendem Druck zunimmt“. Ostwald verkaufte das Patent an die BASF. Aus seiner Idee konnten Fritz Haber (1868–1934) und Carl Bosch (1874–1940) in der Folgezeit ein industrielles Verfahren zur Erzeugung von Ammoniak im großtechnischen Maßstab entwickeln. Das Haber-Bosch-Verfahren ist heute das bedeutendste.
Im Labor kann man Ammoniak durch das Erhitzen von mit Calciumchlorid gesättigter Ammoniaklösung herstellen oder durch das Erhitzen eines Gemisches aus Calciumhydroxid und Ammoniumchlorid:
CaC2 + N2  CaCN2 + C
CaCN2 + C
CaCN2 + 3 H2O CaCO3 + 2 NH3
CaCO3 + 2 NH3
CaCN2 + 3 H2O
1900 meldete Wilhelm Ostwald (1853–1932) ein Patent zur „Herstellung von Ammoniak und Ammoniakverbindungen aus freiem Stickstoff und Wasserstoff" an. Im Labormaßstab gelang es ihm durch "geeignete Kontaktsubstanzen oder Katalysatoren bereits bei geringer Erhitzung auf 250 bis 300 °C“ Ammoniak herzustellen. In der gleichen Patentschrift empfahl er die Durchführung unter hohem Druck, „da die verhältnismäßige Menge des Ammoniaks im Gasgemisch mit steigendem Druck zunimmt“. Ostwald verkaufte das Patent an die BASF. Aus seiner Idee konnten Fritz Haber (1868–1934) und Carl Bosch (1874–1940) in der Folgezeit ein industrielles Verfahren zur Erzeugung von Ammoniak im großtechnischen Maßstab entwickeln. Das Haber-Bosch-Verfahren ist heute das bedeutendste.
Im Labor kann man Ammoniak durch das Erhitzen von mit Calciumchlorid gesättigter Ammoniaklösung herstellen oder durch das Erhitzen eines Gemisches aus Calciumhydroxid und Ammoniumchlorid:
2 NH4Cl + Ca(OH)2  CaCl2 + 2 NH3 + 2H2O
CaCl2 + 2 NH3 + 2H2O
Ammoniak ist ein bedeutender Grundstoff zur Herstellung anderer chemischer Verbindungen wie Harnstoff, Blausäure, Natriumcarbonat oder Salpetersäure. Es wird auch zur Herstellung von Sprengstoffen, Chemiefasern oder Kunstharzen benötigt. Zur Herstellung von Düngemitteln stellt das Gas ein wichtigstes Zwischenprodukt dar. In Rauchgasentschwefelungsanlagen wandelt Ammoniak das Schwefeldioxid zu Ammoniumsulfat um, das ebenfalls als Düngemittel verwendet werden kann. Rettungssanitäter benutzen ein Riechstäbchen, welches eine verdünnte Ammoniaklösung enthält, und halten dies kurz an die Nase einer ohnmächtigen Person. Von dem Ammoniakgeruch wacht die Person auf. Mit Wasser erhält man Ammoniaklösung (weitere Anwendungen siehe dort).
Weitere Infos und Medien
Der Laugen- und Basenbegriff
Ammoniaksynthese im Haber-Bosch-Verfahren
Digitale Folien: Säuren, Laugen, Salze
Buch individuell erstellen: Basis-Text Ammoniak und Ammoniaklösung


> Inhaltsverzeichnis
Weitere Infos und Medien
Der Laugen- und Basenbegriff
Ammoniaksynthese im Haber-Bosch-Verfahren
Digitale Folien: Säuren, Laugen, Salze
Buch individuell erstellen: Basis-Text Ammoniak und Ammoniaklösung


> Inhaltsverzeichnis
© Thomas Seilnacht / Benutzerhandbuch / Lizenzbestimmungen / Impressum / Datenschutz / Literaturquellen