 |
 Farblose Tafeln oder Schuppen |
Molmasse 166,132 g/mol AGW keine Angaben Dichte 2,18 g/cm3 Schmelzpunkt +191 °C (geschlossene Kapillare) Zersetzung +230 °C Wasserlöslichkeit Konz. bei 20 °C 5,74 g/l Flammpunkt +168 °C |
| Piktogramme GHS 07 Achtung |
Gefahrenklassen
+ Kategorie Ätz-/Reizwirkung auf die Haut 2 Schwere Augenschäd./-reizung 2 Spez. Zielorgantox. e. Atemwege 3 |
HP-Sätze (siehe auch Hinweis) H 315, 319, 335 P 261, 280.1-3, 302+352, 305+351+338, 312 Entsorgung G 3 |
| Etikett drucken | Dt. Bezeichnung Synonyme (deutsch) |
Engl. Bezeichnung Synonyme (engl.) |
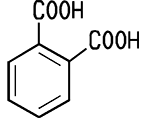
| CAS 88-99-3 | Phthalsäure Benzol-1,2-dicarbonsäure |
Phthalic acid Benzene-1,2-dicarboxylic acid |
| Eigenschaften Phthalsäure bildet
ein weißes, kristallines Pulver oder farblose Tafeln und Schuppen,
die in kaltem Wasser nur wenig, in heißem Wasser und Ethylalkohol
gut löslich sind. Beim Erhitzen spaltet
Phthalsäure Wasser ab, wobei Phthalsäureanhydrid entsteht. Phthalsäure
gehört zu den aromatischen Dicarbonsäuren. Es existieren drei
stellungsisomere Dicarbonsäuren:
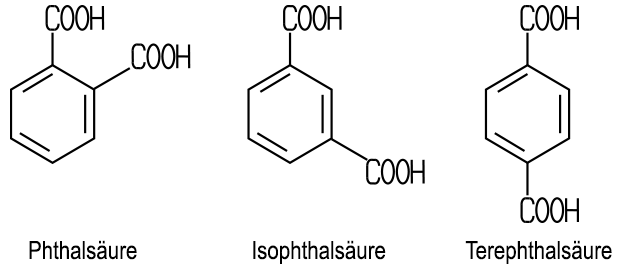 Technische Bedeutung
besitzen nur die Phthalsäure und die Terephthalsäure. Diese beiden
unterscheiden sich in ihren chemischen Eigenschaften und werden
auch nach unterschiedlichen Herstellungsverfahren synthetisiert. Die Phthalsäure ist wenig wasserlöslich, die Isophthalsäure ist dagegen kaum noch wasserlöslich und die Terephthalsäure praktisch gar nicht mehr. Dies liegt daran, dass die gegenüberliegenden COOH-Gruppen im Molekül dazu führen, dass die Moleküle untereinander eine stabile zwischenmolekulare Verknüpfung bilden und dadurch kaum noch mit den Wasser-Molekülen interagieren. Der viel höhere Schmelzpunkt (in geschlossener Kapillare) kann ebenfalls durch die zwischenmolekularen Kräfte erklärt werden. Terephthalsäure
ist ein wichtiger Ausgangsstoff zur Herstellung von Polyesterfasern. |
| Herstellung Es existieren zwei Herstellungsverfahren.
Früher synthetisierte man die Phthalsäure durch eine Oxidation von Naphthalin mit Hilfe eines Vanadin(V)-oxid-Katalysators.
Heute oxidiert man vorwiegend o-Xylol:
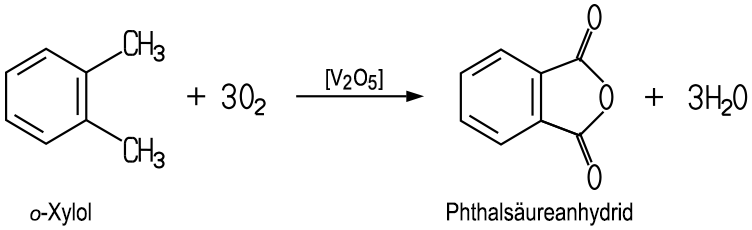 In beiden Fällen
erhält man Phthalsäureanhydrid, das durch das Erwärmen mit Wasser
in Phthalsäure übergeht. Dieser Vorgang kehrt sich beim Erhitzen
der Phthalsäure auf etwa 200 °C wieder um:
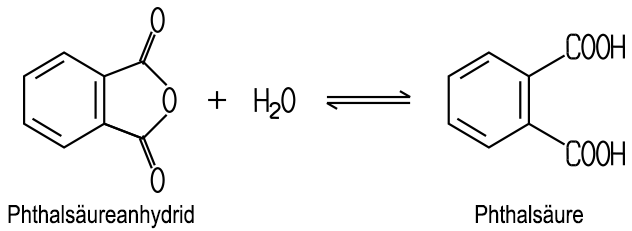 |
| Verwendung Phthalsäure dient wie Phthalsäureanhydrid zur Herstellung von Farbstoffen wie Phenolphthalein und
Fluorescein oder auch zur Synthese von Anthrachinon und von Kunstharzen. Die Phthalsäureester der höheren Alkohole
eignen sich als Weichmacher für PVC. |