Ameisensäure
HCOOH
CAS 64-18-6
Ameisensäure
Methansäure
Methansäure
Formic acid
Methanoic acid
Methanoic acid
Molmasse
AGW
pKs-Wert
Dichte
Schmelzpunkt
Siedepunkt
Wasserlöslichkeit
Explosionsgrenzen
Flammpunkt
Zündpunkt
AGW
pKs-Wert
Dichte
Schmelzpunkt
Siedepunkt
Wasserlöslichkeit
Explosionsgrenzen
Flammpunkt
Zündpunkt
46,026 g/mol
5 ml/m3 (TRGS 900)
+3,75
1,220 g/cm3
+8,3 °C
+101 °C
vollständig mischbar
18 bis 57 Vol.-% (Luft)
+50 °C
+434 °C
5 ml/m3 (TRGS 900)
+3,75
1,220 g/cm3
+8,3 °C
+101 °C
vollständig mischbar
18 bis 57 Vol.-% (Luft)
+50 °C
+434 °C
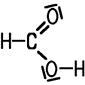
Klare, farblose Flüssigkeit
Flasche mit Entlüftungsventil

Gefahrenklassen + Kategorie
Entzündbare Flüssigkeiten 3
Akute Toxizität oral 4
Akute Toxizität inhalativ 3
Ätzwirkung auf die Haut 1A
(Abstufung bei Verdünnungen)
Entzündbare Flüssigkeiten 3
Akute Toxizität oral 4
Akute Toxizität inhalativ 3
Ätzwirkung auf die Haut 1A
(Abstufung bei Verdünnungen)
Reine Ameisensäure im Labor muss in einem Behälter mit Entlüftungsventil aufbewahrt werden, da sich bei der Zersetzung Gase bilden, die den Behälter platzen lassen können. Begünstigt wird dies vor allem dadurch, wenn die Flasche zu warm gelagert wird oder wenn die Ameisensäure verunreinigt ist. Die Aufbewahrung der reinen, 100%igen Ameisensäure erfolgt einzeln und separiert in einem Sicherheitsschrank mit dauerhafter Ablüftung über einer Auffangwanne, niemals zusammen mit Schwefelsäure. Flaschen ohne Druckausgleich dürfen nur hinter einer Schutzscheibe mit stabilen Schutzhandschuhen geöffnet werden. Ameisensäure ist eine besonders gefährliche Säure. Im Schullabor sollte nur eine mit Wasser verdünnte, maximal 85%ige Säure aufbewahrt werden. Aber auch stärker verdünnte Ameisensäure kann zu schweren Augenverletzungen oder beim Einatmen zu Atemnot führen. Beim Arbeiten mit der Säure sind geschlossener Arbeitskittel, Schutzbrille, Gesichtsschild und Schutzhandschuhe zu tragen. Es muss aufgrund der reizenden Dämpfe stets im Abzug gearbeitet werden. Auch beim Arbeiten mit ameisensäurehaltigen Abfluss- oder WC-Reinigern müssen immer Schutzbrille und Schutzhandschuhe getragen werden! Diese Reiniger dürfen nur bei einer guten Raumlüftung eingesetzt werden. Das WC ist nach der Reinigung mit viel Wasser zu spülen.
Wirkung auf den menschlichen Körper
Die klare, stark stechend riechende Flüssigkeit reizt die Augen und die Atemwege und führt zu Verätzungen und Blasenbildungen auf der Haut. Beim Verheilungsprozess bilden sich Narben. Die Schleimhäute werden beim Einatmen gereizt, es können sogar Blasen im Mund und Rachenraum entstehen. Als Folge kann eine Atemnot auftreten, bei höheren Konzentrationen treten schwere Verätzungen im Rachenraum oder in der Speiseröhre auf.
Ameisensäure in Flasche mit Entlüftungsventil
Chemisch-physikalische Eigenschaften
Die Ameisensäure wird von verschiedenen Tieren wie Ameisen oder Laufkäferarten und von Pflanzen wie die Brennnessel als Verteidigungswaffe eingesetzt. Die stilettartigen Brennhaare der Brennnessel sind an der Spitze mit einem Widerhaken versehen. Direkt unterhalb der Spitze ist das Brennhaar stark verdünnt, so dass die Spitze bei einer bloßen Berührung abbricht. Die dabei entstehende scharfe Kanüle dringt in die Haut des Menschen ein und der Zellsaft gelangt in den Körper. Im Zellsaft kann man das Histamin Arecocholin und verschiedene organische Stoffe wie Ameisensäure oder Natriumformiat nachweisen.
Ameisensäure ist im Gegensatz zu den langkettigen Carbonsäuren wie Stearinsäure aufgrund ihrer Polarität sehr gut wasserlöslich. In Ethylalkohol, Diethylether und Glycerin löst sie sich ebenfalls sehr gut. Sie ist die stärkste aller Carbonsäuren. Eisen, Zink, Magnesium und andere unedle Metalle lösen sich unter Wasserstoffentwicklung auf. Dabei bilden sich die Salze der Ameisensäure, die Formiate (nach IUPAC Methanoate). Mit Natrium entsteht Natriumformiat, mit Magnesium bildet sich Magnesiumformiat:
Aufgrund ihrer vorhandenen Aldehydgruppe wirkt Ameisensäure als Reduktionsmittel, so dass beispielsweise eine ammoniakalische Silbernitratlösung zu Silber reduziert wird. Bei höheren Temperaturen zerfällt sie in Gegenwart von Katalysatoren in Kohlenstoffdioxid und Wasserstoff. Mit Luft entstehen bei 14 bis 33 Volumenprozent explosive Gemische. Mit Alkoholen können Ester erzeugt werden. Für die Ester-Reaktion sind jedoch Wärme und ein Katalysator wie konzentrierte Schwefelsäure notwendig:
Durch das Erhitzen eines Gemisches aus reiner Ameisensäure mit konzentrierter Schwefelsäure erhält man Kohlenstoffmonooxid. Dieser Versuch ist jedoch nicht ganz ungefährlich, da Kohlenstoffmonooxid sehr leicht Knallgasgemische mit Luft bildet. Der Zersetzungsprozess kann schon bei leicht erhöhter Raumtemperatur auch ohne Schwefelsäure stattfinden:
Die klare, stark stechend riechende Flüssigkeit reizt die Augen und die Atemwege und führt zu Verätzungen und Blasenbildungen auf der Haut. Beim Verheilungsprozess bilden sich Narben. Die Schleimhäute werden beim Einatmen gereizt, es können sogar Blasen im Mund und Rachenraum entstehen. Als Folge kann eine Atemnot auftreten, bei höheren Konzentrationen treten schwere Verätzungen im Rachenraum oder in der Speiseröhre auf.
Ameisensäure in Flasche mit Entlüftungsventil
Chemisch-physikalische Eigenschaften
Die Ameisensäure wird von verschiedenen Tieren wie Ameisen oder Laufkäferarten und von Pflanzen wie die Brennnessel als Verteidigungswaffe eingesetzt. Die stilettartigen Brennhaare der Brennnessel sind an der Spitze mit einem Widerhaken versehen. Direkt unterhalb der Spitze ist das Brennhaar stark verdünnt, so dass die Spitze bei einer bloßen Berührung abbricht. Die dabei entstehende scharfe Kanüle dringt in die Haut des Menschen ein und der Zellsaft gelangt in den Körper. Im Zellsaft kann man das Histamin Arecocholin und verschiedene organische Stoffe wie Ameisensäure oder Natriumformiat nachweisen.
Ameisensäure ist im Gegensatz zu den langkettigen Carbonsäuren wie Stearinsäure aufgrund ihrer Polarität sehr gut wasserlöslich. In Ethylalkohol, Diethylether und Glycerin löst sie sich ebenfalls sehr gut. Sie ist die stärkste aller Carbonsäuren. Eisen, Zink, Magnesium und andere unedle Metalle lösen sich unter Wasserstoffentwicklung auf. Dabei bilden sich die Salze der Ameisensäure, die Formiate (nach IUPAC Methanoate). Mit Natrium entsteht Natriumformiat, mit Magnesium bildet sich Magnesiumformiat:
Magnesium + Ameisensäure  Magnesiumformiat + Wasserstoff
Magnesiumformiat + Wasserstoff
Aufgrund ihrer vorhandenen Aldehydgruppe wirkt Ameisensäure als Reduktionsmittel, so dass beispielsweise eine ammoniakalische Silbernitratlösung zu Silber reduziert wird. Bei höheren Temperaturen zerfällt sie in Gegenwart von Katalysatoren in Kohlenstoffdioxid und Wasserstoff. Mit Luft entstehen bei 14 bis 33 Volumenprozent explosive Gemische. Mit Alkoholen können Ester erzeugt werden. Für die Ester-Reaktion sind jedoch Wärme und ein Katalysator wie konzentrierte Schwefelsäure notwendig:
Ameisensäure + Ethanol  Ameisensäureethylester + Wasser
Ameisensäureethylester + Wasser
Durch das Erhitzen eines Gemisches aus reiner Ameisensäure mit konzentrierter Schwefelsäure erhält man Kohlenstoffmonooxid. Dieser Versuch ist jedoch nicht ganz ungefährlich, da Kohlenstoffmonooxid sehr leicht Knallgasgemische mit Luft bildet. Der Zersetzungsprozess kann schon bei leicht erhöhter Raumtemperatur auch ohne Schwefelsäure stattfinden:
HCOOH  CO + H2O
CO + H2O
Im Jahr 1671 destillierte der britische Naturforscher John Ray (1627–1705) Ameisen und gewann daraus eine Säure. Um das Jahr 1749 gelang dem deutschen Chemiker Andreas Sigismund Marggraf (1709–1782) die reine Darstellung der Ameisensäure. Das Kochen vom Ameisen und nachträgliche Abdestillieren der Säure darf heute aus Tierschutzgründen nicht mehr durchgeführt werden. In der chemischen Industrie wird Ameisensäure aus Natriumhydroxid und Kohlenstoffmonoxid bei 210 °C unter hohem Druck hergestellt. Das entstehende Zwischenprodukt Natriumformiat HCOONa wird mit Schwefelsäure zersetzt, wobei die Ameisensäure entsteht:
1. Schritt: NaOH + CO  HCOONa
HCOONa
2. Schritt: HCOONa + H2SO4 H-COOH + Na2SO4
H-COOH + Na2SO4
2. Schritt: HCOONa + H2SO4
Ameisensäure dient zum Desinfizieren von Wein- und Bierfässern und als Putzmittel in WC-Reinigern. Salze wie Calciumformiat werden als Hilfsmittel in der Textil- und Lederindustrie zum Imprägnieren, Beizen oder Entkalken von Leder eingesetzt. Ameisensäure und ihre Salze waren früher als Lebensmittelzusatzstoffe zur Konservierung von Fruchtsäften zugelassen. Heute ist diese Verwendung verboten.
Weitere Infos und Medien
Carbonsäuren als Stoffgruppe in der organischen Chemie
Arbeiten mit WC-Reinigern im Haushalt
Der Säurebegriff im Haushalt und in der Chemie
Weitere Infos und Medien
Carbonsäuren als Stoffgruppe in der organischen Chemie
Arbeiten mit WC-Reinigern im Haushalt
Der Säurebegriff im Haushalt und in der Chemie
© Thomas Seilnacht / Benutzerhandbuch / Lizenzbestimmungen / Impressum / Datenschutz / Literaturquellen