Eiweiße oder Proteine
sind aus Aminosäuren aufgebaut. In der Natur gibt es wahrscheinlich
mehrere hundert Aminosäuren, so konnte man sie sogar auf Kometen oder
in Meteoriten nachweisen. Am Aufbau der Eiweiße im menschlichen Körper
sind jedoch nur proteinogene Aminosäuren
beteiligt. Aminosäuren enthalten sowohl die Carboxy-Gruppe COOH als
auch die Amino-Gruppe NH2. Die proteinogenen Aminosäuren
gehören zu den α-Aminosäuren,
da bei ihnen die Aminogruppe am α-Kohlenstoff-Atom
sitzt, das direkt mit der Carboxy-Gruppe verknüpft ist. Die einfachste α-Aminosäure
ist Glycin oder Aminoethansäure.
Nach dem Dreibuchstabencode erhält Glycin den Code Gly.
Der Rest (grün markiert)
kann aus verschiedenen Atomgruppierungen bestehen. Beim Alanin (2-Aminopropansäure)
besteht dieser Rest beispielsweise aus der Alkylgruppe -CH3.
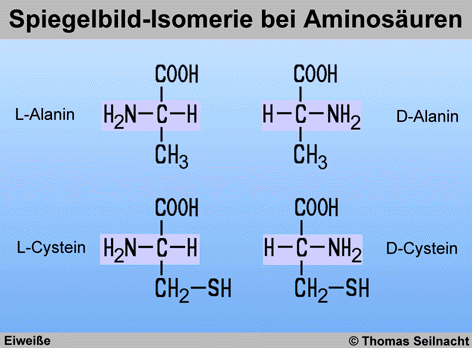
Vom Alanin existieren zwei Enantiomere, die sich spiegelbildlich unterscheiden.
Mit Ausnahme des Glycins zeigen die Aminosäuren Spiegelbild-Isomerie.
Cystein ist eine Aminosäure, die ein Schwefel-Atom
enthält, beim Selenocystein ist dieses Schwefel-Atom durch ein Selen-Atom ersetzt.
Bis heute sind 20 proteinogene
Aminosäuren bekannt, die im menschlichen Genom codiert und
als Aminosäuren zum Aufbau von Eiweißen erkannt werden. Darüber
gibt es noch weitere proteinogene Aminosäuren im menschlichen Körper,
die zwar genetisch nicht codiert werden, aber als Produkt bei Stoffwechselprozessen
entstehen. In der Regel liegen die proteinogenen Aminosäuren in der
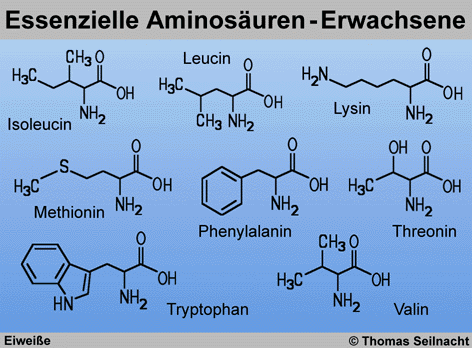
L-Form vor. Essenzielle Aminosäuren müssen
über die Nahrung aufgenommen werden und können vom Körper
nicht selbst produziert werden. Erwachsene benötigen acht essenzielle
Aminosäuren. Kinder und Schwangere sind noch auf zwei weitere angewiesen:
Cystein und Tyrosin.
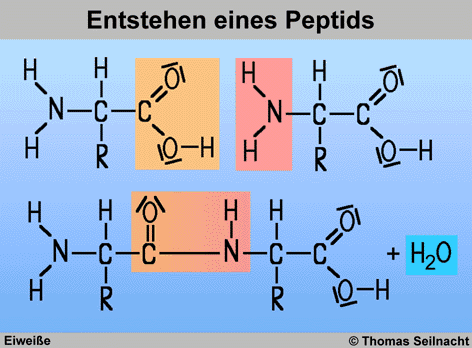
Die Aminogruppe in einer
Aminosäure kann mit der Carboxy-Gruppe einer anderen Aminosäure
unter Wasserspaltung reagieren. Die dabei entstehende C-N-Bindung wird
als Peptid-Bindung bezeichnet. Auf diese Art und Weise können Molekülketten
mit vielen verknüpften Aminosäuren entstehen. Enthalten die kettenförmigen
Moleküle weniger als 100 Aminosäuren-Bausteine, handelt es sich
um Peptide. Schließen sich die Aminosäuren
zu Ketten mit vielen hunderten Bausteinen zusammen, erhält man Proteine,
die Eiweiße.
Bei 20 vorliegenden Aminosäuren ergeben sich eine enorme Menge an Möglichkeiten, verschiedene Verknüpfungen herzustellen. Das Leben auf der Erde nutzt diese Möglichkeiten und
konstruiert eine Vielzahl an Eiweißstrukturen mit speziellen Aufgaben.
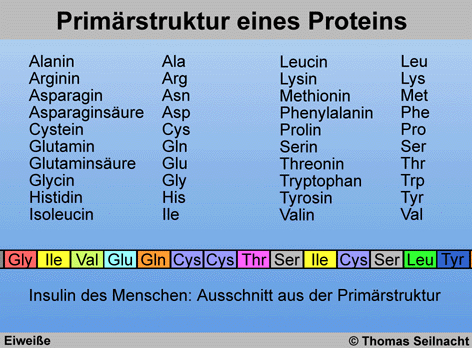
Um die Übersicht zu behalten, hat man 20 Aminosäuren mit einem
Dreibuchstabencode oder einem Einbuchstabencode versehen. Die Sequenz,
also die Reihenfolge der Verknüpfungsbausteine, wird als Primärstruktur
eines Proteins bezeichnet.
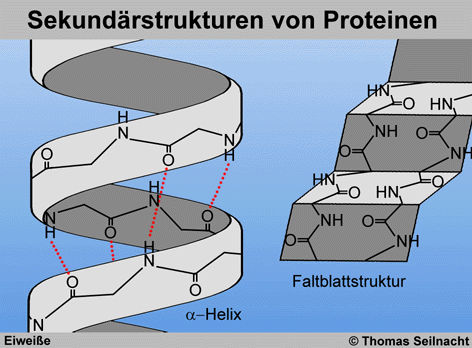
Die Peptid-Bindung ist
um die Kohlenstoffbindungen um das α-Kohlenstoff-Atom
drehbar, dadurch ordnen sich die Eiweiß-Moleküle räumlich
an. Eine Möglichkeit ist die α-Helix,
in der die Aminosäure-Sequenzen in einer spiralförmig gewundenen
Kette durch Wasserstoffbrücken verbunden sind. Pro Windung kommen
3,6 Sequenzen vor. Sowohl die α-Helix als auch die Faltblattstruktur (β-Faltblatt) wird durch Wasserstoffbrücken zwischen den Peptidgruppen stabilisiert; in der α-Helix entstehen sie innerhalb derselben Polypeptidkette, im β-Faltblatt zwischen benachbarten Kettenabschnitten. Diese durch Drehbarkeit und Faltbarkeit sowie durch intermolekulare Kräfte
verursachte räumliche Anordnung bildet die Sekundärstruktur
der Proteine. Proteine können aber auch gemischte Anordnungen ausbilden.
Die relative Anordnung der Sekundärstrukturen untereinander nennt
man Tertiärstruktur. Es existieren Protein-Moleküle
mit mehreren Ketten oder solche, die untereinander einen großen Verband
bilden, dieses komplexe System beschreibt die Quartärstruktur.
Die Proteine können
in zwei Gruppen unterschieden werden: Die fibrillären
Proteine oder Faserproteine sind zu
dicken Kabeln und Strängen gewunden. Sie finden sich in Haaren, in
Muskeln, in den Spinnfäden der Insekten, in Krallen und in Häuten.
Auch Wolle und Seide
ist aus Faserproteinen aufgebaut. Die Molekülform der globulären
Proteine ist dagegen eher kugelförmig. Ein Beispiel dafür
ist das Hämoglobin, das für den Sauerstofftransport im Blut verantwortlich
ist. Faserproteine besitzen eher stützende Funktionen, globuläre
Proteine sorgen für den Ablauf biochemischer Funktionen. Dabei bestimmt
die Form des Moleküls die Funktion des Proteins. Während die
Moleküle der Proteine in einer Muskelsehne spiralig in einer Helix
aufgerollt sind und dadurch die Elastizität der Sehne erklärt
wird, sind Hämoglobin-Moleküle räumlich ausgedehnt und lassen
im Inneren genug Platz für die Einlagerung von Sauerstoff.
Globuläre Proteine
sind gut wasserlöslich, oder sie können Wasser gut aufnehmen.
Zu ihnen gehört das Albumin, das man im menschlichen Organismus im
Blut als Steuerprotein des osmotischen Drucks findet. Albumin ist auch
in Milch und Eiern reichlich enthalten. Das Eiklar im Hühnerei kann
viel Wasser binden. Beim Schlagen von Eiklar mit einem Schneebesen bildet
sich Schaum, da Luftbläschen in die Eiweißstrukturen eingeschlossen
werden. Gleichzeitig wird das Protein teilweise denaturiert und noch aufnahmefähiger
für Wasser. Bei der Denaturierung von
Eiweiß wird die Sekundär-, Tertiär und Quartärstruktur
verändert, ohne dass die Primärstruktur berührt ist. Eine
Denaturierung kann auch durch Hitzeeinwirkung, UV-Strahlung, radioaktive
Strahlung oder durch die Einwirkung von Stoffen wie Wasser, Säuren,
Laugen oder Alkohol erfolgen.
Faserproteine wie das
Keratin bauen beim Menschen Haare und Nägel auf. Faserproteine sind
nicht wasserlöslich. Zwischen den spiralförmig gewundenen
Faserproteinen in einem Haar sind Bindungskräfte wirksam, wodurch
Kabelstränge entstehen, die Mikrofibrillen. Hunderte von Mikrofibrillen
bilden ein unregelmäßiges Bündel, die Makrofibrillen. Mehrere
Makrofibrillen sind zu einem Faserstrang zusammengefasst. Die Summe aller
Faserstränge bildet den Haar-Schaft. Das Bindegewebe von Haut, Fleisch
und Knochen ist aus dem Protein Collagen aufgebaut. Früher stellte
man daraus das Bindemittel Knochenleim her.
Beim Kochen in Wasser quillt das Faserprotein unter Wasseraufnahme stark
auf. Nach dem Abkühlen bildet sich ein Eiweiß-Wasser-Gel, bei
dem die Wassermoleküle zwischen den Fasersträngen eingeschlossen
sind. Die so gebildete Gelatine ist
ein Eiweißprodukt, das man durch Kochen aus Schwarten und Knochen
von Schlachtabfällen gewinnt. Getrocknete Gelatine kann sehr viel
Wasser aufnehmen, sie wird in zahlreichen Nahrungsmitteln als Gelierungsmittel
für Flüssigkeiten eingesetzt. Sie dient aber auch zur Herstellung
von Arzneimittelkapseln, da sich diese im Magen gut auflösen.
Die Proteine besitzen
im Organismus eine Vielzahl an Funktionen. Strukturproteine wie Collagen
machen mindestens 30 Prozent des Körperproteins im Menschen aus. Sie bauen
die Haut, das Bindegewebe und die Knochen auf. Die Enzyme
gehören zu den globulären Proteinen. Sie wirken als Biokatalysator
zum Einleiten von Stoffwechselprozessen. Bei der Verdauung werden die Proteine
durch die Enzyme zunächst zu Peptiden und anschließend zu den
Aminosäuren zerlegt, die dann vom Blut aufgenommen und zu den Zellen
transportiert werden. Die Aminosäuresequenzen werden für die
Protein-Biosynthese benötigt, bei der
Proteine mit Hilfe der DNA und den Ribosomen aufgebaut werden. Proteine
besitzen darüber hinaus eine große Bedeutung als Transport-,
Regel- oder Steuerstoffe - beispielsweise bei den Hormonen. Proteine können
auch zur Abwehr von Krankheiten eingesetzt werden: Die von den weißen
Blutzellen produzierten Antikörper gehören zur Gruppe der Immunglobuline.
In Eier-, Milch-, Fisch-
und Fleischprodukten kommen Eiweiße reichlich vor. Aber auch Hülsenfrüchte
wie Erbsen, Bohnen oder Sojabohnen und einige Samen und Nüsse wie
Erdnüsse, Kürbiskerne oder Sonnenblumenkerne sind reich an Eiweißen.
Nahrungsmittel mit einem hohen Anteil an essenziellen Aminosäuren
haben eine hohe biologische Wertigkeit. Die
Bezugsgröße mit dem Wert 100 Prozent ist das Voll-Ei. Die Sojabohnen
stellen eines der hochwertigsten eiweißhaltigen, pflanzlichen Nahrungsmittel
dar. Die biologische Wertigkeit der Eiweiße im Weizenmehl ist zwar
deutlich geringer, aber es enthält neben den Kohlenhydraten Klebstoffe,
die aus Gluten oder Klebereiweiß bestehen. Diese bestimmen die Backeigenschaften
des Mehls erheblich. Beim Brotbacken hält das Klebereiweiß Wasser
und das von der Hefe gebildete Kohlenstoffdioxid in kleinen Poren fest,
dadurch „geht“ der Teig und bläht sich auf. Dies führt beim Backen
zu einem lockeren Gebäck. Beim Backen wird das Wasser wieder abgegeben,
dieses verkleistert die Stärke zum typischen Brot.
| Nahrung
pro 100 g |
Eiweißgehalt gesamt | Biologische Wertigkeit | Fettgehalt gesamt | Kohlenhydrate verwertbar |
| Hühnerei | 6 g | 100 % | 5,5 g | 0,3 g |
| Kuhmilch | 3,3 g | 88 % | 3,8 g | 5 g |
| Rindfleisch | 21 g | 92 % | 5 g | 0 |
| Thunfisch | 21 g | 92 % | 15 g | 0 |
| Sojabohnen | 35 g | 85 % | 18 g | 6 g |
| Reis | 7 g | 80 % | 2 g | 74 g |
| Weizenmehl | 11 g | 50 % | 1 g | 71 g |
Bei der Fäulnis
zersetzen Fäulnisbakterien die Eiweiße zu Ammoniak
und Schwefelwasserstoff. Es können
gleichzeitig auch weitere giftige Abbauprodukte entstehen, die bei einem
verdorbenen Nahrungsmittel Übelkeit und Magenverstimmungen auslösen.
Beim Erhitzen eines Eiweißes kann ebenfalls Ammoniak und Schwefelwasserstoff
entstehen. Darauf beruhen der chemische Nachweis
von gebundenem Stickstoff und der Nachweis
von Schwefel. Einfache Proteine und Peptide werden im chemischen Labor
mit der Biuret-Reaktion, Proteine mit aromatischen
Aminosäuren-Bausteinen wie Phenylalanin werden mit der Xanthoprotein-Reaktion
nachgewiesen.
Buch individuell erstellen: Basis-Text Eiweiße


> Inhaltsverzeichnis