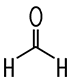
| Inhalt Vorkommen Herstellung Funktionelle Gruppe Eigenschaften und Nachweis Verwendung | 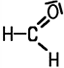 Methanal, Formaldehyd | Die Aldehyde oder Alkanale als Stoffgruppe erkennt man
an der C=O-Doppelbindung (Carbonylgruppe), die mit mindestens einem
H-Atom verbunden ist. Methanal ist der einfachste Vertreter. |
Vorkommen
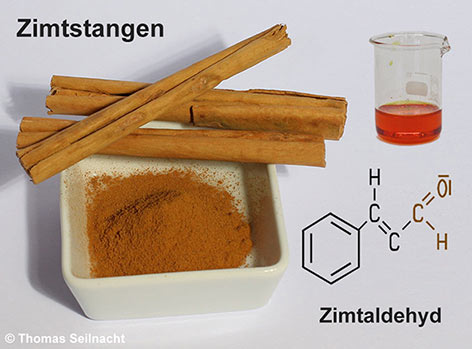
Stoffe aus der Gruppe der Aldehyde mit natürlichem Ursprung sind in Nahrungsmitteln und in Duftstoffen als Aroma- oder Geruchsstoffe weit verbreitet. In Äpfeln, Birnen oder Kirschen findet man zum Beispiel Hexanal, ein aliphatischer Aldehyd, der sich in der Natur aus Fettsäuren bildet. In den Bittermandeln oder im Wein findet sich Benzaldehyd. Zimtaldehyd ist ein weiterer aromatischer Aldehyd, er ist der Hauptbestandteil des Zimtöls. Dieses erzeugt das Aroma des Zimtgewürzes.
Herstellung
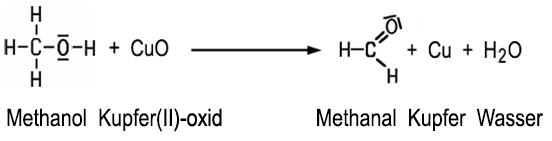
Die Bezeichnung Aldehyde ist vom Begriff Alcohol dehydrogenatus abgeleitet. Sie wurde von Justus von Liebig im Jahre 1835 eingeführt. Die Aldehyde können im Labor durch den Entzug von zwei Wasserstoff-Atomen aus einem primären Alkohol hergestellt werden. Bei der Oxidation von Methylalkohol mit heißem Kupfer(II)-oxid wird das Kupfer(II)-oxid reduziert, und es entsteht neben Kupfer auch Methanal und Wasser:
| Oxidation von Methanol |
 |
|
Taucht
man ein erhitztes und oxidiertes Kupfer-Drahtnetz in Methanol, entsteht als Oxidationsprodukt Methanal. >Film |
Funktionelle Gruppe
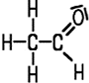
Die entstehende C=O-Doppelbindung nennt man Carbonyl-Gruppe. Sie kommt neben den Aldehyden auch in den Ketonen vor. Wenn mindestens ein H-Atom an die Carbonylgruppe gebunden ist, handelt es sich um einen Aldehyd. Die Aldehyd-Gruppe bezeichnet die funktionelle Gruppe der Aldehyde. Der Name wird aus dem Grundgerüst der vergleichbaren Alkane gebildet und erhält die Endung -al.
Die entstehende C=O-Doppelbindung nennt man Carbonyl-Gruppe. Sie kommt neben den Aldehyden auch in den Ketonen vor. Wenn mindestens ein H-Atom an die Carbonylgruppe gebunden ist, handelt es sich um einen Aldehyd. Die Aldehyd-Gruppe bezeichnet die funktionelle Gruppe der Aldehyde. Der Name wird aus dem Grundgerüst der vergleichbaren Alkane gebildet und erhält die Endung -al.
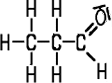
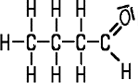
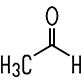
| Formaldehyd | Acetaldehyd | Propionaldehyd | Butyraldehyd |

|
|
|
|
 |
 |
 |
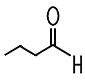 |
| Methanal | Ethanal | Propanal | Butanal |
| Siedepunkt −19°C | Siedepunkt +21°C | Siedepunkt +49°C | Siedepunkt +75°C |
Eigenschaften und Nachweis
Die Aldehyd-Gruppe ist
wie die Hydroxy-Gruppe (OH-Gruppe) der Alkohole
polar, allerdings nicht ganz so stark. Daher sind die kurzkettigen Aldehyde
ebenfalls wasserlöslich. Mit zunehmender Länge des Alkyl-Rests nimmt der unpolare Anteil im Verhältnis zum polaren Anteil im Molekül zu, so dass die Wechselwirkungen mit den Wasser-Molekülen gestört werden. Mit steigender Kettenlänge nimmt
die Wasserlöslichkeit ab. Die Siedepunkte der Aldehyde liegen aufgrund der Polarität
höher als die der Alkane, aber etwas niedriger als die der entsprechenden
Alkohole. Mit zunehmender Kettenlänge steigen die Siedepunkte. Der Grund dafür ist, dass größere Moleküle stärkere Van-der-Waals-Kräfte ausüben.
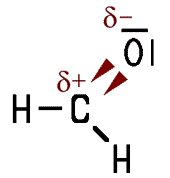
Polarität der Carbonyl-Gruppe
Die kurzkettigen Aldehyde sind wie die Alkohole leicht entzündbar. Im Labor wird zur Abgrenzung von einem Keton zuerst die Probe mit Schiffs Reagenz durchgeführt, wobei eine rotviolette Färbung entsteht. Die Aldehyde reagieren positiv bei der Tollens-Probe, aliphatische Aldehyde auch bei der Fehling-Reaktion.
|
|
| Reaktion eines Aldehyds mit Schiffs Reagenz |
Die C=O-Doppelbindung
ist nicht sehr stabil, daher zeigen Aldehyde wie Formaldehyd eine große Vielfalt chemischer Reaktionen.
Die Aldehyde können zu Carbonsäuren
oxidiert werden, Essigsäure kann man zum Beispiel aus einem Aldehyd herstellen.
Aldehyde wirken reduzierend, sie reduzieren eine ammoniakalische
Silbernitrat-Lösung, wobei sich ein Spiegel von elementarem Silber
im Reagenzglas bildet. Die Carbonyl-Gruppe wird oxidiert, die Silber-Ionen
werden reduziert:
| Aldehydnachweis mit der Tollens-Probe |
R-CHO + 2 Ag+ + 2 OH− |
| Aldehyde reduzieren eine ammoniakalische Silbernitratlösung zu Silber. |
Verwendung
Die kurzkettigen Aldehyde
stellen in der organischen Chemie wichtige Zwischenprodukte zur Herstellung
von Kunststoffen dar und dienen als Desinfektions- und Konservierungsmittel.
Die längerkettigen Aldehyde werden als Riechstoffe in der Parfümindustrie
verwendet. Aromatische Aldehyde wie Benzaldehyd sind Rohstoffe zur Herstellung
von Medikamenten, Parfümen und Farbstoffen.
Buch individuell erstellen: Basis-Text Aldehyde


> Inhaltsverzeichnis
Buch individuell erstellen: Basis-Text Aldehyde


> Inhaltsverzeichnis