In der Natur kommen Stoffe nur selten als Reinstoffe vor. Meistens handelt es sich um Stoffgemische,
die sich aus mindestens zwei Reinstoffen zusammensetzen. Selbst eine hochreine
Laborchemikalie ist niemals zu einhundert Prozent rein, sie enthält immer einige
Verunreinigungen, wenn auch nur in geringem Maße. Stoffgemische findet
man überall. Betrachtet man ein Stück rötlichen Granit,
sieht man verschiedene Bestandteile: Transparenter Quarz, roter und weißer
Feldspat, sowie schwarzer Glimmer. Wenn man das Granitstück mit einem
Hammer zerkleinert, kann man es in die einzelnen Bestandteile auftrennen. Beim Granit sind die einzelnen Bestandteile
deutlich erkennbar. Die Bestandteile liegen alle im festen Zustand vor,
ein solches Gemisch nennt man auch Gemenge.
Vermischt man Salatöl
und Wasser, schwimmt das Öl aufgrund seiner geringeren Dichte zunächst auf dem Wasser. Durch kräftiges Schütteln vermischen
sich die beiden Flüssigkeiten teilweise. Dieses Gemisch von zwei Flüssigkeiten
bezeichnet man als Emulsion.
Auch Milch ist eine Emulsion
von Fett-Tröpfchen in Wasser. Dass bei der Milch ein Stoffgemisch vorliegt,
kann man erst unter dem Mikroskop erkennen. Die kleinen Punkte auf dem
Bild zeigen die Fett-Tröpfchen in der Milch bei tausendfacher Vergrößerung:
Vermischt man einen festen
Stoff mit einer Flüssigkeit, erhält man eine Suspension.
Beim Verrühren von Gartenerde in Wasser sind die festen Bestandteile
der Erde auch ohne Mikroskop zu erkennen. Sie setzen sich nach einer Weile
am Boden des Gefäßes ab. Sind die Bestandteile eines Stoffgemisches mit den Augen oder mit Hilfe eines Mikroskops noch zu erkennen, liegt ein heterogenes Stoffgemisch vor.
Wenn man einen Goldbarren
herstellt, versucht man möglichst reines Gold zu verwenden. Die kleinen Goldbarren auf der Abbildung unten besitzen eine
Reinheit von 999,9. Das bedeutet sie enthalten mindestens 99,99% Massenanteile
Gold. Der Goldring mit dem innen versehenen Stempel 585 enthält einen
garantierten Goldgehalt von 58,5% Gold, der restliche Anteil setzt sich
aus Silber, Kupfer oder Platin zusammen. Hier liegt ebenfalls ein Stoffgemisch
in Form einer Legierung vor. Als Legierung bezeichnet man ein Stoffgemisch, bei dem mindestens eine Komponente aus
einem Metall besteht. Das goldgelbe Messing enthält beispielsweise
kein Gold, sondern die Messing-Legierung setzt sich aus den Komponenten Kupfer und Zink zusammen. Bronze wäre eine Legierung aus Kupfer und Zinn.
Die einzelnen Komponenten einer Legierung kann man jedoch selbst mit einem Mikroskop nicht mehr erkennen.
Derartige Stoffgemische nennt man homogene Stoffgemische.
Nicht nur Legierungen bilden homogene Stoffgemische, sondern auch Lösungen
und Gemische verschiedener Gase. Beim Streuen von Kochsalz in Wasser löst
sich das Salz allmählich auf und ist nach einer Weile nicht mehr zu sehen. Dass es noch im Wasser gelöst ist, kann leicht mit der Geschmacksprobe feststellen.
Andere Salze wie das Kaliumpermanganat lösen sich
unter Ausbildung einer farbigen Lösung. Schichtet man über das
Kaliumpermanganat ganz vorsichtig Wasser, erhält man zunächst
die getrennten Komponenten. Doch selbst wenn das Gefäß danach völlig ruhig steht, vermischen sich die beiden Komponenten allmählich. Man erklärt sich das Phänomen dadurch, dass die enthaltenen Atome ständig in Bewegung sind und dadurch die Komponenten vermischen. Diese Durchmischung, die durch die Eigenbewegung der Atome verursacht wird, nennt man Diffusion.
Manchmal findet beim Lösungsvorgang eine Erwärmung statt, in seltenen Fällen sogar eine Abkühlung, beispielsweise beim Lösen
von Kaliumnitrat in Wasser. Lösungen findet man nicht nur bei Stoffgemischen von einer Flüssigkeit mit
einem Feststoff, sondern auch bei Mischungen von Gasen oder anderen Flüssigkeiten
mit einer Flüssigkeit. Wein ist eine Lösung von Alkohol in Wasser, sowie anderen gelösten Bestandteilen, zum Beispiel Zucker
oder Aromastoffe. Erhitzt man gewöhnliches Wasser in einem Glasgefäß,
steigen zunächst kleine Gasbläschen auf: Durch das Erhitzen wird
der gelöste Sauerstoff aus dem Wasser zuerst
in kleinen Bläschen ausgetrieben, bevor die größeren Wasserdampfblasen
aufsteigen (>Experiment).
dann erst beginnt der Verdampfungsprozess des Wassers (untere Bilder) |
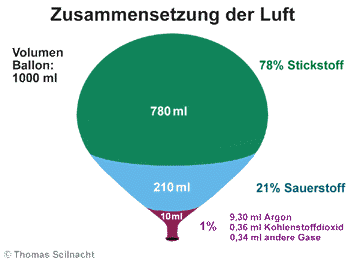
Ein Beispiel für ein homogenes Stoffgemisch zwischen mehreren Gasen, stellt die gewöhnliche Atemluft dar. Sie enthält als Hauptbestandteil 78% Volumenanteile Stickstoff, 21% Volumenanteile Sauerstoff und 1% Volumenanteil an anderen Gasen wie Argon oder Kohlenstoffdioxid.
 |
Die Stoffgemische kann man nach dem Aggregatzustand der Komponenten in einer Tabelle zusammenfassen. Heterogene Stoffgemische sind in der Tabelle blau gekennzeichnet, homogene Stoffgemische orange.
| Stoffgemisch | fest | flüssig | gasförmig |
| in fest | Legierung
(Messing) Gemenge (Granit) Haufwerk (Kieshaufen) |
Schwamm | Hartschaum |
| in flüssig | Lösung
(Salzlösung) Suspension (Schlamm) |
Lösung
(Wein) Emulsion (Milch) |
Lösung
(Mineralwasser) Schaum (Seifenschaum) |
| in gasförmig | Rauch (Zigarettenrauch) | Nebel | Gasgemisch (Luft) |
Stoffe vermischen
Das Vermischen von Stoffen im Labor oder in der Industrie erfolgt beispielsweise durch Schütteln, Vermengen, Walzen, Kneten, Emulgieren (Zugabe eines Emulgators bei der Herstellung einer Hautcreme), Suspendieren oder Lösen. Hierbei wird das Vermischen durch Zerkleinern, Rühren oder Heizen beschleunigt. Das Ablaufen einer unerwünschten chemischen Reaktion lässt sich mit Kühlen und mit einer exakten Temperaturmessung verhindern. Die Stoffportionen der einzusetzenden Komponenten können durch Wägen oder durch Volumenmessungen bestimmt werden.
Stoffe trennen
Nach der allgemeinen Definition findet bei der Vermischung der beteiligten Stoffe keine chemische Reaktion statt. Trotzdem lassen sich für die Gemische physikalische Eigenschaften – beispielsweise Dichte oder Siedepunkte – angeben. Die Stoffgemische lassen sich durch physikalische Trennverfahren in ihre Komponenten zerlegen. Bei der Trinkwasserreinigung werden unerwünschte Komponenten durch die Stofftrennungen beseitigt. Im chemischen Labor gehören die verschiedenen Trennverfahren zu den wichtigsten chemischen Grundoperationen. Die Gemische werden aufgrund der unterschiedlichen chemischen und physikalischen Eigenschaften der beteiligten Komponenten aufgetrennt:
Nach der allgemeinen Definition findet bei der Vermischung der beteiligten Stoffe keine chemische Reaktion statt. Trotzdem lassen sich für die Gemische physikalische Eigenschaften – beispielsweise Dichte oder Siedepunkte – angeben. Die Stoffgemische lassen sich durch physikalische Trennverfahren in ihre Komponenten zerlegen. Bei der Trinkwasserreinigung werden unerwünschte Komponenten durch die Stofftrennungen beseitigt. Im chemischen Labor gehören die verschiedenen Trennverfahren zu den wichtigsten chemischen Grundoperationen. Die Gemische werden aufgrund der unterschiedlichen chemischen und physikalischen Eigenschaften der beteiligten Komponenten aufgetrennt:
- Nach Art der Zusammensetzung: Beim Sortieren lassen sich die Komponenten aufgrund ihrer verschiedenartigen Zusammensetzung trennen. Als Beispiel hierfür dient die Mülltrennung.
- Nach der Dichte: Beim Aufschlämmen, Sedimentieren, Dekantieren und Zentrifugieren werden die Komponenten aufgrund ihrer unterschiedlichen Dichte getrennt. Beispiel: Beim Abgießen des Kaffees vom Kaffeesatz im Haushalt nutzt man die Schwerkraft und die höhere Dichte des nach unten sich absetzenden Kaffeesatzes aus, um den darüber stehenden Kaffee abzugießen.
- Nach der Partikelgröße: Beim Sieben werden die Stoffteilchen der gröberen Komponente im Sieb zurückgehalten. Beim Filtrieren einer Suspension bleibt die Feststoffkomponente im Filterpapier zurück.
- Nach der Magnetisierbarkeit: Bei der Magnettrennung werden magnetisierbare Komponenten mit einem (Elektro-)Magnet herausgezogen.
- Nach dem Siedepunkt: Beim Destillieren werden Flüssigkeiten durch Erhitzen voneinander getrennt. Die Komponente mit dem niedrigeren Siedepunkt verdampft zuerst, sie kondensiert danach in einem Kühler.
- Nach dem Sublimationspunkt: Hat man ein Stoffgemisch, bei dem einer der Stoffe sublimiert, kann dieser Stoff durch Sublimieren abgetrennt werden.
- Nach der Wirksamkeit der Oberflächenkräfte: Bei der Adsorption wird eine gasförmige oder flüssige Komponente durch die Oberflächenkraft eines anderen Stoffes – zum Beispiel durch Aktivkohle – festgehalten.
- Nach dem Kristallisationsverhalten: Beim Umkristallisieren wird ein verunreinigter Stoff gelöst und wieder auskristallisiert. Die Verunreinigungen verbleiben in der überstehenden Lösung.
- Aufgrund des Lösungsverhalten der Komponenten in einer Flüssigkeit: Bei der Extraktion wird ein Stoff aus einer Flüssigkeit, aus einem Feststoffgemisch oder aus einem Gasgemisch mit einem flüssigen Lösungsmittel abgetrennt.
- Aufgrund des Lösungsverhaltens einer Gaskomponente: Bei der Absorption lösen sich gasförmige Verunreinigungen in einer Flüssigkeit (Waschmittel) oder in einem Feststoff.
- Aufgrund von Verunreinigungen durch Wasser: Beim thermischen Trocknen wird das Stoffgemisch erhitzt oder an der Luft stehen gelassen. Im ersten Fall verdampft das Wasser im zweiten Fall verdunstet es. Beim chemischen Trocknen reagiert ein zugegebener Stoff mit dem Wasser und entzieht dem Gemisch dadurch das Wasser.
- Auftrennung aufgrund unterschiedlicher Wechselwirkungen (Löslichkeit oder Adsorption) der Komponenten mit einer zugegebenen Phase: Chromatografie.
Weiteres Material zum Thema
Chemische Grundoperationen
Digitale Folien
Buch individuell erstellen: Basis-Text Stoffgemische


> Inhaltsverzeichnis