Die im Labor verwendeten Stoffe müssen oft frei von Feuchtigkeit sein, da das Wasser die Wägungen verfälscht, aber auch chemische Reaktionen behindert oder verändert. Die einfachste Möglichkeit, einen Stoff zu trocknen, besteht darin, ihn an der Luft stehen zu lassen. Das Trocknen erfolgt durch Verdunstung. Der Vorgang kann durch das Auflegen auf ein Filterpapier noch beschleunigt werden.
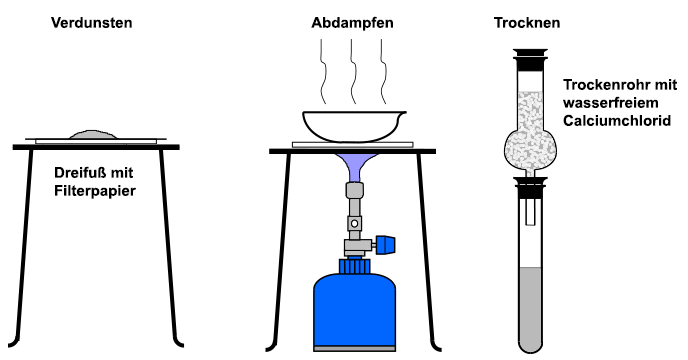 Bei stabilen anorganischen Stoffen kann man die Feuchtigkeit auch einfach in einer Porzellanschale
abdampfen. Zum einfachen Trocknen setzt man auf Laborgefäße
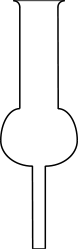
ein Trockenrohr (früher auch Chlorcalciumrohr genannt), das mit wasserfreiem,
gekörntem Calciumchlorid gefüllt
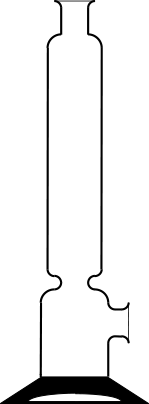
wird. Der Exsikkator ist ein
gängiges Laborgerät zum Trocknen und zum Aufbewahren von Stoffen.
Er besteht aus einem Unterteil und einem Deckel, der mit einem Hahn versehen
ist. Der Planschliff zwischen beiden Teilen wird mit ein wenig Paraffinöl eingeschmiert.
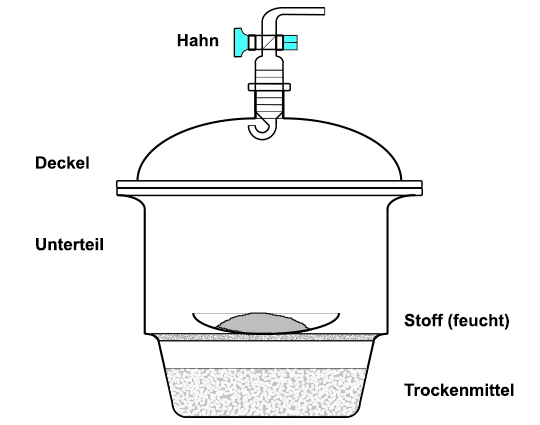
Aufbau und Funktionsweise eines Exsikkators Im Unterteil befindet sich eine siebartig durchlöcherte Porzellanplatte, unter der sich ein wasserentziehendes Trockenmittel befindet. In der Schule verwendet man meist wasserfreies Calciumchlorid oder Kieselgel. Der Deckel wird von der Seite her aufgesetzt und auch wieder abgenommen. Zur Beschleunigung des Trocknungsvorganges kann der Exsikkator evakuiert werden. Befindet sich ein Vakuum in dem Exsikkator, darf er wegen der Implosionsgefahr nicht mehr transportiert werden und sollte unter einer Schutzhaube aus Drahtnetz stehen.
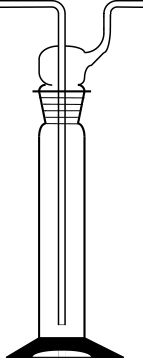
In Trockenpistolen werden Flüssigkeiten verdampft und in ein Gefäß geleitet, in dem sich die Trockensubstanz befindet. Sie sind in den Schulen jedoch kaum verbreitet. Viel häufiger wird der Trockenschrank benutzt (siehe >Heizen). Vakuum-Trockenschränke lassen sich sogar evakuieren.
Destilliert man Ethanol aus einem Ethanol-Wassergemisch, zum Beispiel aus Wein (>Schülerübung), gelingt es nicht das Wasser durch Destillation vollständig abzutrennen. Durch mehrfaches Destillieren beim „Schnapsbrennen“ erhält man ein azeotropes Alkohol-Wasser-Gemisch mit etwa 95% Alkoholgehalt. Der Wasserentzug gelingt mit einer erneuten Destillation unter Zugabe eines wasserentziehenden Stoffes, beispielsweise mit gebranntem Kalk, wasserfreiem Kupfersulfat oder geglühter Pottasche. Als Trockenmittel im Labor eignen sich metallisches Natrium, wasserfreies Calciumchlorid, Phosphorpentoxid, wasserfreie Schwefelsäure, Kieselgel oder wasserfreies Natriumsulfat. Bei der Trocknung von Flüssigkeiten ist darauf zu achten, dass das Trockenmittel nicht mit der zu trocknenden Flüssigkeit reagiert. So darf man Halogenalkane zum Beispiel nicht mit Natrium trocknen. Gase trocknen
Zum Trocknen von Gasen
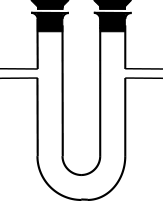
leitet man das Gas durch ein geeignetes Trockenmittel. Werden Feststoffe
als Trockenmittel eingesetzt, verwendet man Trockenrohre, U-Rohre oder
Trockentürme. Flüssige Trockenmittel füllt man in Gaswaschflaschen,
durch die das Gas geleitet wird. Beim Waschen von Gasen werden Verunreinigungen
durch ein geeignetes Waschmittel beseitigt (siehe >Absorbieren).
Sauer reagierende Gase dürfen nur mit sauren Trockenmitteln und basisch
reagierende Gase nur mit alkalischen Trockenmitteln getrocknet werden.
Die Tabelle gibt eine Übersicht, welche Trockenmittel für Gase geeignet sind:
*) Trockenmittel: A: wasserfreies Calciumchlorid B: Kieselgel C: Kalium- oder Natriumhydroxid, zum Waschen auch als Lösung D: Phosphorpentoxid E: Schwefelsäure wasserfrei |
© Thomas Seilnacht / Benutzerhandbuch / Lizenzbestimmungen / Impressum / Datenschutz / Literaturverzeichnis