|
Die Chromatografie wurde von dem russischen Biologen Michael Tswett (1872–1919) im ersten Jahrzehnt des 20. Jahrhunderts erstmals zur Trennung von Farbstoffen aus Pflanzen angewandt. Es handelt sich dabei um ein Stofftrennungsverfahren, bei dem sich die Stoffe aufgrund unterschiedlicher Wechselwirkungen zwischen Löslichkeit und Adsorption ihrer Komponenten mit einer zugegebenen Phase auftrennen.
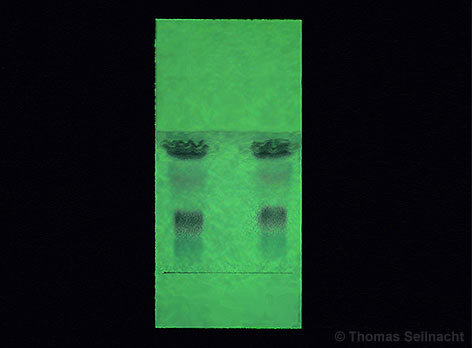
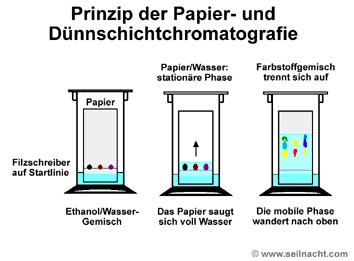
Papier-Chromatogramme auf Filterpapier mit verschiedenen schwarzen Filzschreibern Friedlieb Ferdinand Runge (1795–1867) legte mit seinen einfachen Papier-Chromatogrammen die Grundlagen für die moderne Chromatografie. Bei der Papier-Chromatografie (PC) wird zum Beispiel ein Farbstoff-Gemisch auf einem punktförmigen Startpunkt eines Filterpapiers aufgetragen. Dann stellt man das Papier in einen Behälter mit Deckel
und gibt ein geeignetes Lösungsmittel wie Wasser
hinzu. Das Papier saugt sofort von unten her das Wasser auf.
Das Papier ist das Trägermaterial und stellt die stationäre Phase
dar. Das Wasser bewegt sich über die Farbstoffe und transportiert
sie mit. Manche Farbstoff-Komponenten lösen sich besser im Wasser,
andere haften besser am Filterpapier. So trennt sich das
Farbstoff-Gemisch in seine Komponenten. Das aufsteigende Wasser als
Fließmittel ist die mobile Phase.
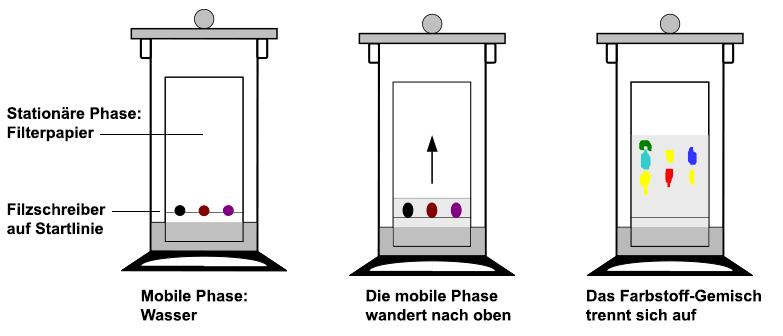 Prinzip der Papier-Chromatografie Dünnschicht-Chromatografie
Bei der Dünnschicht-Chromatografie (DC) werden statt Papier fein pulverisierte Materialien wie Kieselgel, Cellulose oder Aluminiumoxid auf dünne Plexiglas-Plättchen aufgetragen. Sie beruht auf dem gleichen Prinzip wie die Papier-Chromatografie. Ihre Vorteile liegen in einer schnellen Laufzeit und in einer hohen Nachweisempfindlichkeit. Die Trägermaterialien sind im Handel als fertige DC-Folien erhältlich. Die Methoden der Dünnschicht-Chromatografie entwickelte der deutsche Pharmazeut Egon Stahl (1924–1986). Mit Hilfe dieser Methode kann man beispielsweise die Farbstoffe in den Blättern von Laubbäumen bestimmen. Meistens wird ein Alkohol-Wasser-Gemisch verwendet. Auch Ammoniak-Lösung und Natriumcitrat werden hinzugegeben, um die Homogenität des Fließens zu gewährleisten. Sollen gleichzeitig alkohol- und wasserlösliche Stoffe abgetrennt werden, dann kann auch das Wasser eine stationäre Phase darstellen, da der Alkohol als mobile Phase mit den im Alkohol löslichen Stoffen schneller als das Wasser fließt.
Sind die zu trennenden Stoffe farblos, müssen sie sichtbar gemacht werden. Man kann die aufgetrennten Stoff-Komponenten mit einem Reagenz besprühen, das eine Farb-Reaktion verursacht, oder man macht sie mit UV-Licht sichtbar. Manche DC-Platten sind mit einem Fluoreszenz-Farbstoff beschichtet, der nicht wandert und bei einer bestimmten Wellenlänge Fluoreszenz zeigt. Tragen die DC-Platten die Bezeichnung UV254, dann leuchten sie bei Bestrahlung mit kurzwelligem UV-Licht der Wellenlänge 254 Nanometer. Die abgetrennten Komponenten erscheinen dunkel vor der leuchtenden DC-Platte, wenn sie nicht selbst fluoreszieren.
Säulen-Chromatografie
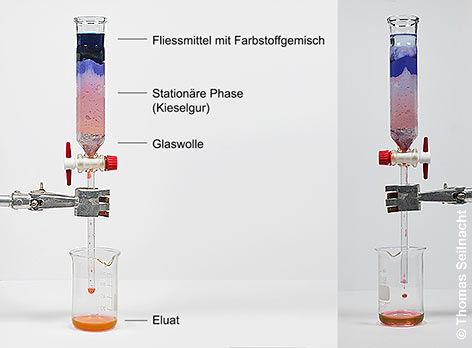
Bei der von Michael Tswett entwickelten Säulen-Chromatografie (SC) wird ein langgezogener Behälter verwendet, der mit einem Trägermaterial als stationäre Phase gefüllt ist. Das Laufmittel mit den gelösten Stoffen fließt aufgrund der Schwerkraft nach unten. Tswett verwendete pulverisiertes Calciumcarbonat, das er in Petrolether aufschlämmte. Heute verwendet man Kieselgur, Cellulose, Stärke oder Aluminiumoxid als stationäre Trägermaterialien. Die stationäre Phase muss dicht gestopft werden, so
dass keine Lücken entstehen. Damit der Hahn nicht verstopft, kann
Glaswolle oder Watte eingefügt werden. Gibt man auf die Säule
einen Benzin-Extrakt der grünen Blatt-Farbstoffe,
läuft der Extrakt nach unten, und die
Pflanzenfarbstoffe
trennen sich auf. Die am schnellsten wandernden Farbstoffe
treten unten zuerst aus der Säule als Eluat heraus. Die Säulen-Chromatografie eignet sich besonders
zum Auftrennen größerer Stoffmengen.
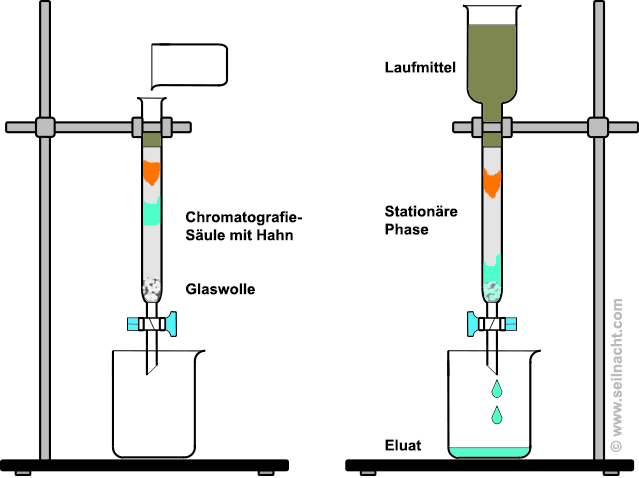
Prinzip der Säulenchromatografie Ionenaustausch-Chromatografie
Bei der Ionenaustausch-Chromatografie kann die gleiche Apparatur wie bei der Säulenchromatografie verwendet werden. Als Trägermaterial für die mobile Phase eignen sich Stoffe, die Kationen oder Anionen an sich binden können und dabei andere Moleküle im Austausch abgegeben. Nach diesem Prinzip gewinnt man im Labor mit einem Ionenaustausch-Gerät „destilliertes“ Wasser. 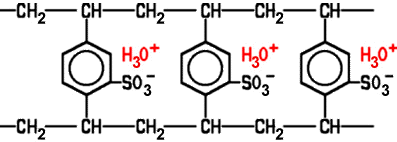 Polystyrolsulfonsäure-Harz in H+-Form als Kationen-Austauscher Kationen-Austauscher enthalten chemisch gebundene Sulfonsäure-Gruppen (-SO3H) oder Carboxy-Gruppen (-COOH), die als Protonenspender fungieren. Zunächst reagieren die H+-Ionen der Kationen-Austauscher mit Wasser-Molekülen
zu H3O+-Ionen. Diese
können im Austausch gegen positiv geladene Kationen aus der Lösung
wieder abgegeben werden. Bei den Anionen-Austauschern werden Hydroxid-Ionen OH− gegen Anionen aus der Lösung ausgetauscht. Die Ionenaustausch-Chromatografie
dient im Labor besonders zur Trennung von Aminosäuren. Bei der technischen
Wasserreinigung zur Trinkwassergewinnung kann man mit Hilfe des Verfahrens Schwermetall-Ionen aus dem Wasser abtrennen.
Gas-Chromatografie
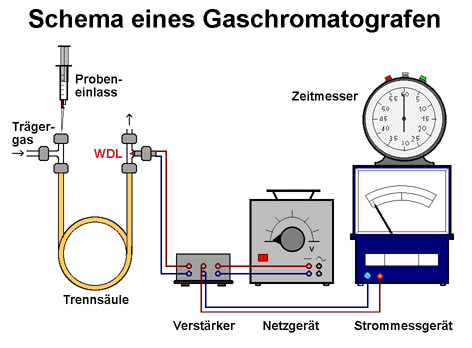
Nach dem Zweiten Weltkrieg wurden Verfahren entwickelt, bei denen Gase als mobile Phase bei der Chromatografie dienten. Bei der Gas-Chromatografie (GC) lassen sich Gemische aus Gasen oder verdampfbaren (in der Regel organischen) Stoffen trennen. Als mobile Trägergase dienen Helium, Argon, Stickstoff oder einfach Luft wie in unserem Beispiel. Statt einer Säule werden spiralförmige Rohre mit geringem Durchmesser mit wenigen Millimetern verwendet, durch die der Gasstrom geleitet wird. Die Säulen werden mit einem Trägermaterial wie Kieselgel oder Silicon-Öl als stationäre Phase gefüllt. Das zu analysierende Stoffgemisch wird mit Hilfe einer Mikrospritze vor der Trennsäule am Probeneinlass in den Gasstrom injiziert. Die zu trennenden Stoffe laufen aufgrund ihres unterschiedlichen Lösungs- oder Adsorptionsverhaltens unterschiedlich schnell durch die stationäre Phase in der Säule. Am Ende der Säule misst ein sehr empfindlicher Wärmeleitfähigkeits-Detektor WDL auftretende Temperaturschwankungen. Kleine Moleküle unterscheiden sich stark von der Wärmeleitfähigkeit größerer Moleküle. Sobald eine aufgetrennte Komponente des ursprünglichen Stoffgemischs aus der Säule austritt, findet eine Temperaturerhöhung statt. Der Detektor misst die Änderung und stellt sie über eine elektronische Steuerungseinheit als Peak dar. Einfache Gaschromatografen zeigen den Peak nur als Ausschlag bei einem Messgerät. Schreibgeräte, durch die eine Papierbahn läuft, zeigen ein grafisch dargestelltes Zeit-Ausschlags-Diagramm.
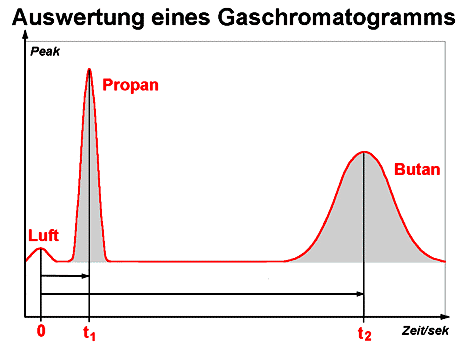
An der Reihenfolge und der Höhe der Peaks können die Stoffkomponenten bestimmt werden. Die Zeitmessung beginnt nach dem Auftreten des Trägergas-Peaks, in unserem Fall beim Luft-Peak, t=0). Die Zeitspanne bis zum Auftreten der weiteren Peaks wird als Retentionszeit bezeichnet
(Propan t1, Butan t2). Die Flächenmaße des Peaks geben auch Aufschluss über die Konzentrationen der vorliegenden Komponenten. Im Beispiel war im Gasgemisch mehr Butan als Propan enthalten.
Moderne Gas-Chromatografen besitzen computergesteuerte Auswertungsprogramme. Sie weisen noch Stoffe in Konzentrationen von weniger als ein Millionstel ppm nach. Zur Einstellung einer konstanten Temperatur liegt die Trennsäule bei Gas-Chromatografen oft in einem Wasserbad, das durch einen Thermostat gesteuert wird. Kopiervorlagen zur Chromatografie |