Der Naturstoff Wasser
Das Wasser bedeckt zu mehr
als zwei Drittel die Erdoberfläche und ist die Ursubstanz für
die Entstehung des Lebens. Die Schülerinnen und Schüler begegnen zunächst im Unterricht
in vielfältiger Art und Weise dem Wassers. Sie machen eine Exkursion
an einen Bach und führen Gewässeruntersuchungen durch. Sie hören
Musik zum Thema Wasser, betrachten Bilder oder lesen Texte
und Gedichte.
|
|
Wasser ist einem ewigen
Kreislauf unterworfen, die Sonne verdunstet es zu Wasserdampf, als Regen
kommt es wieder auf die Erde zurück. Im Winter und in kalten Gegenden
gefriert es zu Eis, das auf dem Wasser schwimmt. Nachdem die Schülerinnen und Schüler
mit diesem Kreislauf vertraut gemacht wurden, studieren sie die verschiedenen
Erscheinungsformen von Wasser genauer. Diese Versuche eignen sich zum Thema:
Wasser wird auf einer Heizplatte in einem Gefäß aus Glas erhitzt und die sichtbaren Vorgänge während des Aufheizens und beim Kochen werden in einem Protokoll genau beschrieben. Dabei ist zu beobachten, dass sich zuerst Luftblasen am Boden und am Gefäßrand sammeln, die mit der Zeit aufsteigen. Beim Sieden des Wassers sind fast alle Luftblasen am Boden verschwunden und nur noch Wasserdampfblasen steigen auf. Diese Unterscheidung der unterschiedlichen, aufsteigenden Blasen wird den Schülerinnen und Schülern erst durch eine sehr genaue Beobachtung klar. Der Dampf beschlägt nach dem Heraustreten aus dem Wasser den oberen Gefäßrand oder verteilt sich im Raum.
Wasser wird auf einer Heizplatte in einem Gefäß aus Glas erhitzt und die sichtbaren Vorgänge während des Aufheizens und beim Kochen werden in einem Protokoll genau beschrieben. Dabei ist zu beobachten, dass sich zuerst Luftblasen am Boden und am Gefäßrand sammeln, die mit der Zeit aufsteigen. Beim Sieden des Wassers sind fast alle Luftblasen am Boden verschwunden und nur noch Wasserdampfblasen steigen auf. Diese Unterscheidung der unterschiedlichen, aufsteigenden Blasen wird den Schülerinnen und Schülern erst durch eine sehr genaue Beobachtung klar. Der Dampf beschlägt nach dem Heraustreten aus dem Wasser den oberen Gefäßrand oder verteilt sich im Raum.
|
|
|
Die Schülerinnen und Schüler beobachten
die Entwicklung der Luftbläschen genau. Wann setzen sie ein, wann
hören sie auf? Wie verhält es sich beim erneuten Erhitzen? Diese
Versuche führen zur Frage, von was die Löslichkeit des Luft-Sauerstoffs
im Wasser abhängig ist?
Analog zu diesem Versuch
kann auch kohlensäurehaltiges Mineralwasser erhitzt werden. Hier kennen
die Schülerinnen und Schüler manche Phänomene aus ihrem Alltag: Warum sprudelt
kaltes Mineralwasser weniger als warmes? Die Lernenden erkennen, dass
die Löslichkeit von Gasen im Wasser sowohl von der Außentemperatur
als auch von dem Außendruck abhängt. Je höher die Temperatur
und je geringer der Druck, umso schlechter die Löslichkeit. Dies kann
auch dadurch gezeigt werden, dass man eine zu drei Vierteln gefüllte
Mineralwasserflasche verschließt und kräftig schüttelt.
Die Entwicklung der Gasbläschen setzt wieder ein, sobald man die Flasche
öffnet und den Druck entlässt.
Die Bedeutung des Sauerstoff-Kreislaufs in einem Gewässer schließt sich an. Es wird gezeigt, dass eine geringfügige Erhöhung der Temperatur um 1 °C bei der Einleitung von erwärmten Kühlwasser aus einem Kraftwerk zu einer Gefährdung des Ökosystems führen kann, da die Fische dann wesentlich weniger Sauerstoff zum Atmen haben.
Im nächsten Schritt überlegen sich die Schülerinnen und Schüler, wie sie Wasserdampf wieder zurückgewinnen können. Manche haben schon beobachtet, wie Wasserdampf an kalten Scheiben kondensiert. Sie entwerfen eine technische Anordnung, die sich eignet, auch größere Mengen an Dampf zu kondensieren. Die Anordnungen werden diskutiert und dann ausprobiert. Dazu passt auch eine Schülerübung zur Destillation von Wein.
Zur Verdeutlichung der Druckwirkung beim Verdampfen von Wasser werden natürliche Phänomene gezeigt, beispielsweise die Wirkung eines Geysirs. In einem Versuch kann gezeigt werden, dass Dampf einen Stopfen aus einem Reagenzglas katapultieren oder ein Gewicht in einem Kolben nach oben treiben kann. Das Prinzip der Dampfmaschine wird im Fach Technik erläutert. Dieser Versuch ist sehr einfach durchzuführen und sehr spektakulär (Schutzbrille tragen!):
Die Bedeutung des Sauerstoff-Kreislaufs in einem Gewässer schließt sich an. Es wird gezeigt, dass eine geringfügige Erhöhung der Temperatur um 1 °C bei der Einleitung von erwärmten Kühlwasser aus einem Kraftwerk zu einer Gefährdung des Ökosystems führen kann, da die Fische dann wesentlich weniger Sauerstoff zum Atmen haben.
Im nächsten Schritt überlegen sich die Schülerinnen und Schüler, wie sie Wasserdampf wieder zurückgewinnen können. Manche haben schon beobachtet, wie Wasserdampf an kalten Scheiben kondensiert. Sie entwerfen eine technische Anordnung, die sich eignet, auch größere Mengen an Dampf zu kondensieren. Die Anordnungen werden diskutiert und dann ausprobiert. Dazu passt auch eine Schülerübung zur Destillation von Wein.
Zur Verdeutlichung der Druckwirkung beim Verdampfen von Wasser werden natürliche Phänomene gezeigt, beispielsweise die Wirkung eines Geysirs. In einem Versuch kann gezeigt werden, dass Dampf einen Stopfen aus einem Reagenzglas katapultieren oder ein Gewicht in einem Kolben nach oben treiben kann. Das Prinzip der Dampfmaschine wird im Fach Technik erläutert. Dieser Versuch ist sehr einfach durchzuführen und sehr spektakulär (Schutzbrille tragen!):
|
|
|
Eine leere Getränke-Dose wird einen Zentimeter hoch mit Wasser gefüllt, mit einer Tuchrolle gefasst und über
der rauschenden Brennerflamme erhitzt, bis das Wasser siedet. Man
lässt das Wasser eine Weile sieden, dreht dann die Dose mit Hilfe
der Tuchrolle um und taucht sie blitzschnell mit der Öffnung nach
unten in eine mit Wasser gefüllte Schale. Unter einem lauten Knack
implodiert die Dose und verformt sich in typischer Art und Weise. Ein ähnlicher
und sehr spektakulärer Versuch kann mit einer Wassertonne im Freien
durchgeführt werden. Dieser Versuch darf jedoch nur von erfahrenen
Lehrkräften durchgeführt werden!
Zum Zeigen, dass die Siedetemperatur des Wassers vom Außendruck abhängt, messen wir mit den Schülerinnen und Schülern bei einer Wanderung auf einen hohen Berg die Siedetemperaturen in unterschiedlichen Höhenlagen. Es zeigt sich, dass die Siedetemperatur des Wassers bei geringerem Außendruck abnimmt. Interessant ist es auch, wenn die Schülerinnen und Schüler die Siedetemperatur selbst bestimmen und ein Zeit-Temperatur-Diagramm (Siedekurve) entwerfen können.
Zum Zeigen, dass die Siedetemperatur des Wassers vom Außendruck abhängt, messen wir mit den Schülerinnen und Schülern bei einer Wanderung auf einen hohen Berg die Siedetemperaturen in unterschiedlichen Höhenlagen. Es zeigt sich, dass die Siedetemperatur des Wassers bei geringerem Außendruck abnimmt. Interessant ist es auch, wenn die Schülerinnen und Schüler die Siedetemperatur selbst bestimmen und ein Zeit-Temperatur-Diagramm (Siedekurve) entwerfen können.
Auch das Eis bietet eine Reihe schöner Experimente. Die Schülerinnen und Schüler erhalten
Eis-Stücke und lassen sie auf dem Wasser schwimmen. Sie beobachten,
wie weit die Blöcke in das Wasser eintauchen. Warum sah die Titanic
den Eisberg nicht? (Eis besitzt bei 0 °C eine Dichte von 0,9168 g/cm³;
aufgrund der Dichte-Differenz zwischen Eis und Meerwasser sind nur 12% eines
Eisberges oberhalb des Wassers sichtbar. Dabei ist noch zu bemerken, dass
der Salzgehalt im Meerwasser und die Temperatur ebenfalls einen geringfügigen
Einfluss auf die Dichte des Meerwassers haben).
Eis wird zerstampft und die Beobachtungen werden genau notiert, die Phänomene diskutiert – zum Beispiel warum der Druck beim Zerstampfen das Eis verflüssigt – und mit Beispielen aus der Natur und dem Alltag verglichen: Warum friert das Meer nicht bis auf den Grund? Überlegen Sie selbst, welche Auswirkungen der Wasserdruck auf die Schmelztemperatur hat! Beim Schlittschuhlaufen verursacht der Druck der Kufen eine Erniedrigung des Schmelzpunktes, so dass sich unter den Kufen eine Wasserschicht bildet, auf der wir letztendlich dann fahren. Haben Sie, lieber Leser, das gewusst?
Eine merkwürdige Erscheinung ist auch die Ausdehnung des Volumens beim Gefrieren von Wasser. Dieses Phänomen wird als Anomalie des Wassers bezeichnet und widerlegt die gängigen Vorstellungen der „Aggregatzustände“, die mit Hilfe eines Teilchenmodells „erklärt“ werden.
Eis wird zerstampft und die Beobachtungen werden genau notiert, die Phänomene diskutiert – zum Beispiel warum der Druck beim Zerstampfen das Eis verflüssigt – und mit Beispielen aus der Natur und dem Alltag verglichen: Warum friert das Meer nicht bis auf den Grund? Überlegen Sie selbst, welche Auswirkungen der Wasserdruck auf die Schmelztemperatur hat! Beim Schlittschuhlaufen verursacht der Druck der Kufen eine Erniedrigung des Schmelzpunktes, so dass sich unter den Kufen eine Wasserschicht bildet, auf der wir letztendlich dann fahren. Haben Sie, lieber Leser, das gewusst?
Eine merkwürdige Erscheinung ist auch die Ausdehnung des Volumens beim Gefrieren von Wasser. Dieses Phänomen wird als Anomalie des Wassers bezeichnet und widerlegt die gängigen Vorstellungen der „Aggregatzustände“, die mit Hilfe eines Teilchenmodells „erklärt“ werden.
Und nun noch eine Frage zum
Überlegen: Haben Sie sich auch schon mal überlegt, warum die
Stoffe im Erdkern bei 10000 °C nicht flüssig oder gar gasförmig
sind? Hinweise finden Sie bei den geologischen
Informationen über den Aufbau der Erde.
Wasser hat bei 4 °C seine
größte Dichte (1 g/cm³). Bei einer Erwärmung sinkt
seine Dichte geringfügig, so hat 25 °C warmes Wasser nur noch eine
Dichte von 0,997071 g/cm³. Das Phänomen der Dichtezunahme von
kaltem Wasser spielt für das Klima in Mitteleuropa eine entscheidende
Rolle: Der Golfstrom ist eine Meeresströmung von Afrika aus quer über
den Atlantik, an die Westküsten von Süd- und Nordamerika und
wieder zurück über den Atlantik in die nördlichen Polarmeere.
Er bringt in höheren Schichten warmes Wasser vom Süden in die
nördlichen Meere. Aufgrund der Abkühlung sinkt das warme (und
dann schwerere) Wasser in den nördlichen Polarmeeren nach unten, kühlt
sich dort ab und fließt in den unteren Schichten wieder zurück
durch den Atlantik in den Süden. Die warme Meeresoberfläche erwärmt
die Luft. Die Warmluft gelangt über Winde nach Mitteleuropa und sorgt
dort für ein warmes Klima. In den letzten Jahren wurde jedoch das
Pumpensystem des Golfstroms durch die selbstverschuldete Erwärmung
der Erdatmosphäre (Treibhauseffekt)
weitgehend lahmgelegt, so dass die Hochdruckgebiete aus dem Atlantik ("Azorenhoch")
für Mitteleuropa zu wenig „Druck“ haben, um die Tiefdruckgebiete aus
den nördlichen Polargebieten zu vertreiben. Die Folge ist eine starke
Zunahme der Niederschläge in Deutschland.
Im Anschluss wird der
Naturstoff Wasser als Stoffgemisch und seine Komponenten näher beleuchtet.
Dazu ist es notwendig, dass wir die mit dem Wasser vermischten Stoffe genauer
untersuchen. Wir erhitzen stark kalkhaltiges
Wasser oder Meerwasser und lassen es vollständig verdampfen. Im Rückstand
erhalten wir einen zweiten „Stoff“, der für die Existenz des „Kalkwassers“
oder des „Salzwassers“ verantwortlich war. Nach diesem analytischen Vorgehen
können wir auch zeigen, dass man durch das Zusammenmischen der Stoffe
wieder das ursprüngliche Wasser erhalten kann.
Die Schülerinnen und Schüler entwickeln
in einem Experiment Trennverfahren, wie man zum Beispiel aus einem Stoffgemisch
– bestehend aus Gartenerde, Wasser und roter Tinte – wieder trinkbares
Wasser zurückgewinnen kann. Zur Initiation wird das Wasser vor den
Augen der Schülerinnen und Schüler mit diesen Stoffen verunreinigt und die Aufgabe
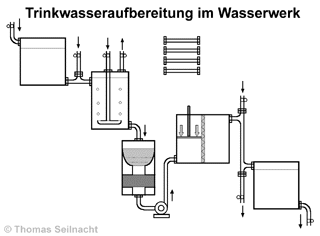
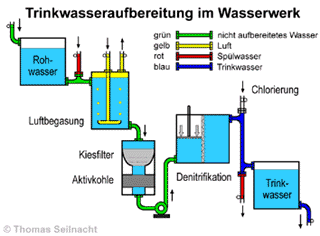
gestellt, wieder die reinen Stoffe zurückzugewinnen. Dabei erfahren sie auch die technischen Grundlagen
der Wasserreinigung in einem Wasserwerk und führen die Verfahren
wie Destillation, Filtration, Absetzen-Lassen und Adsorption in Schülerübungen
durch.
 |
 |
Danach wird untersucht,
welchen Einfluss Verunreinigungen auf das Wasser ausüben. Jedem Kind
ist bekannt, dass Streusalz Eis zum Schmelzen bringt. Warum? Wissen Sie
es, lieber Leser? Wie ändern sich die Siedetemperaturen, wenn man
Verunreinigungen wie Alkohol oder Salze zum Wasser hinzugibt? Auf diese
Fragen finden Sie in den gängigen Chemiebüchern leider nur wenig
Antworten, obwohl derartige Vorgänge in der Natur bei der Entstehung
von Stoffgebilden, zum Beispiel bei der Entstehung
von Mineralien oder von Eiskristallen von großer Bedeutung sind.
Ein weiteres interessantes Thema in diesem Zusammenhang sind chemische Lösungen. Die Schülerinnen und Schüler sollen Lösungen selbst herstellen und die Vorgänge dabei genau beobachten. Sie erkennen, dass sich bestimmte Salze im warmen Wasser besser lösen als im kalten oder dass beim Lösungsvorgang selbst Wärme erzeugt wird. Auch hier können Zeit-Temperatur-Diagramme erstellt werden. Die schönsten Kristallisationsversuche lassen sich mit konzentrierten Salzlösungen durchführen, wenn man diese längere Zeit an der Luft stehen lässt oder einen Impfkristall an einem Wollfaden in die Lösung hängt. Die entstehenden Kristalle sind Stoffgebilde, die einen hohen Grad an Gestaltform und Ordnung besitzen und an deren Bildung das Wasser wesentlich beteiligt ist. Die Bilder zeigen den Stoff Kupfersulfat, wie er in der Natur im Mineral Chalkanthit vorkommt und im Vergleich dazu gezüchtete Kupfersulfat-Kristalle.
Ein weiteres interessantes Thema in diesem Zusammenhang sind chemische Lösungen. Die Schülerinnen und Schüler sollen Lösungen selbst herstellen und die Vorgänge dabei genau beobachten. Sie erkennen, dass sich bestimmte Salze im warmen Wasser besser lösen als im kalten oder dass beim Lösungsvorgang selbst Wärme erzeugt wird. Auch hier können Zeit-Temperatur-Diagramme erstellt werden. Die schönsten Kristallisationsversuche lassen sich mit konzentrierten Salzlösungen durchführen, wenn man diese längere Zeit an der Luft stehen lässt oder einen Impfkristall an einem Wollfaden in die Lösung hängt. Die entstehenden Kristalle sind Stoffgebilde, die einen hohen Grad an Gestaltform und Ordnung besitzen und an deren Bildung das Wasser wesentlich beteiligt ist. Die Bilder zeigen den Stoff Kupfersulfat, wie er in der Natur im Mineral Chalkanthit vorkommt und im Vergleich dazu gezüchtete Kupfersulfat-Kristalle.
|
|