|
Taucht man einen Kupferstab
in eine Kupfer(II)-salzlösung, gehen Kupfer-Ionen in Lösung, während
am Kupferstab die dabei gebildeten Elektronen verbleiben. Dadurch baut
sich ein elektrochemisches Potenzial auf. Dieses verhindert die weitere
Bildung von Kupfer-Ionen, nach einiger Zeit stellt sich ein Gleichgewicht
ein. In der Elektrochemie
wird ein solches Element, bestehend aus einer Kupferelektrode und der entsprechenden
Salzlösung, als Halbzelle bezeichnet (Cu/Cu2+).
Cu
Das Gleichgewicht ist
von der Konzentration der Kupfer-Ionen in der Lösung und von der Temperatur
abhängig. Die Elektronen im Kupfer-Stab bewirken einen Elektronendruck,
die Elektronen könnten mit Hilfe eines elektrischen Leiters abgeleitet
werden. Je besser ein Metall oxidierbar ist, umso mehr Ionen in der Lösung
werden gebildet und umso höher ist der Elektronendruck im Metallstab.
Bei einer Zn/Zn2+-Halbzelle ist der Elektronendruck im Zink-Stab
daher höher als im Kupfer-Stab. Verbindet man die beiden Halbzellen
(Cu/Cu2+und Zn/Zn2+) mit Hilfe einer elektrisch leitfähigen
Brücke, fließen Elektronen vom Zink-Stab zum Kupfer-Stab. Es entsteht
eine messbare, elektrische Spannung. Die absoluten Elektrodenpotenziale
der einzelnen Halbzellen können nicht gemessen werden, es benötigt
immer zwei Halbzellen.
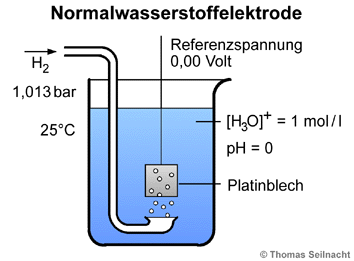
Um damit arbeiten zu
können, wurde als Bezugspunkt die Normalwasserstoffelektrode gewählt.
Eine Platin-Elektrode taucht in eine 25 °C warme Säure-Lösung
mit der Konzentration von 1 Mol pro Liter bei pH=0 und wird von Wasserstoff bei einem
Druck von 1,013 Bar (oder 101,3 Kilopascal) umspült. Diese Halbzelle erhält
das festgelegte Elektrodenpotenzial von E0 = 0,00 Volt als Referenzspannung.
Das Normalpotenzial der anderen Halbzellen
wird immer relativ zur Normalwasserstoffelektrode gemessen. Edle Metalle
stehen in der Tabelle unterhalb des Bezugspunktes,
sie lassen sich schwer oxidieren, sie geben wenig Ionen in die Lösung
ab und bilden in der Elektrode einen niedrigen Elektronendruck aus.
|