| Uran 92U | |||
| engl. Uranium; griech. ouranos („Himmel“), nach dem Planet Uranus | |||
|
|||
Reines
Uran ist ein silbrig glänzendes und relativ weiches Schwermetall.
Alle Uran-Isotope sind radioaktiv und daher instabil. Ihr natürliches
Vorkommen ergibt sich aufgrund der radioaktiven
Zerfallsreihen. An
der Luft läuft das häufigste Isotop Uran-238 infolge einer Oxidation
gelbbraun an.
In pulverisierter Form
ist Uran pyrophor und entzündet sich von selbst. Es ähnelt in
seinen chemischen Eigenschaften dem Actinium. Beim starken Erhitzen verbrennt das Metall zu verschiedenen Uranoxiden.
In heißem Wasser und in verdünnter Salz- oder Salpetersäure
löst es sich unter Wasserstoffentwicklung auf. Gegen Laugen ist es
beständig. Mit den Halogenen bilden sich Halogenide, mit Wasserstoff
Hydride. Mit reinem Sauerstoff reagiert es zu Uran(IV)-oxid:
U + O2 Aufgrund der vielen Verbindungsmöglichkeiten des Uranyl(VI)-Ions UO22+ und des Uranyl(V)-Ions UO2+ mit anderen Bausteinen existieren sehr viele Uranverbindungen. Im Mineralreich sind zum Beispiel mehr als 340 verschiedene Uranminerale bekannt. Die meisten Verbindungen sind gelb, manche auch grün oder orange. Einige zeigen im UV-Licht eine grüne Fluoreszenz. Die wasserlöslichen Salze Uranylacetat Dihydrat UO2(CH3COO)2 • 2 H2O oder Uranylnitrat UO2(NO3)2 sind im Chemikalienhandel erhältlich. Sie werden als Kontrastmittel bei der Elektronenmikroskopie eingesetzt. Uranylnitrat bildet zitronengelbe Kristalle. Das Salz kann durch Auflösen von Uransalzen oder Uranmineralen in konzentrierter Salpetersäure hergestellt werden. Es löst sich im Wasser unter Bildung einer zitronengelben Lösung. Uranverbindungen und deren Lösungen sind stark toxisch und radioaktiv.
Die Borax- oder Phosphorsalzperle färbt sich bei der Vorprobe auf Uran gelb. Das sechswertige Uranyl-Ion UO22+ bildet in essigsaurer Lösung mit Kaliumhexacyanoferrat(II) den rotbraunen, wasserunlöslichen Komplex Dikaliumuranylhexacyanoferrat(II) K2(UO2)[Fe(CN)6]. Bei der Zugabe von Natronlauge entsteht daraus gelbes und stark toxisches Natriumdiuranat Na2U2O7. Mit Kaliumthiocyanat reagieren die Uranyl(VI)-Ionen unter Bildung von orangegelbem Uranylthiocyanat, das in Wasser und in Diethylether löslich ist.
|
| Häufigkeit selten Uran ist selten, es kommt aber auf der Erde etwa 30 Mal häufiger als Silber vor. Das bedeutendste
Uranerz ist die Pechblende,
ein schweres und stark radioaktives Mineral. Wichtige
Förderländer sind Kanada, Australien, Russland, Kasachstan,
Usbekistan, die USA und einige afrikanische Länder. In Deutschland finden sich kleinere Lagerstätten im Krunkelbachtal bei Menzenschwand, im Erzgebirge, im Vogtland oder bei Ronneburg in Thüringen. In den Lagerstätten auf dem Gebiet der ehemaligen der DDR baute man intensiv Uranerz ab. Heute stellen die ehemaligen Gruben eine strahlende Altlast dar. Auch die Grube in Menzenschwand im Schwarzwald ist geschlossen. In der Schweiz existiert eine Lagerstätte im Uranerz-Bergwerk La Creusaz oberhalb von Salvan im Wallis. In Steinmeteoriten findet man ebenfalls Uranverbindungen.
Es kommen in der Natur sehr viele Uranminerale vor, die aus verschiedenen Uranyl-Verbindungen aufgebaut sind, zum Beispiel Heinrichit, Torbernit, Uranophan, Uranosphärit, Walpurgin oder Zeunerit. Die meisten Uranminerale sind bei Tageslicht leuchtend gelb, orange oder grün.
Unter UV-Licht zeigen manche wie der Autunit oder der Uranocircit eine ausgeprägte grün-gelbe Fluoreszenz. Alle Uranminerale sind toxisch und stark radioaktiv.
|
1789
gewann der
deutsche Chemiker Martin Heinrich Klaproth
(1743–1817) in Berlin Urandioxid aus einer Pechblende.
Klaproth hielt dieses zunächst für das neue Element
selbst.
Das Uran war bis zu diesem Zeitpunkt das Element mit der
größten
Atommasse. Daher benannte man es nach dem Planeten Uranus, der
von den damals entdeckten Planeten der äußerste war. Uranus war ein paar Jahre zuvor entdeckt worden. Der Planet und damit auch das Element sind nach dem griechischen Wort ouranos für Himmel benannt.
Die Darstellung von reinem Uran gelang erst 1856 Eugéne-Melchior Péligot (1811–1890) in Paris durch eine Reduktion von Uran(IV)-chlorid. 1896 entdeckte der französische Physiker Henri Becquerel (1852–1908) die radioaktive Strahlung des Elements. Die erste Atomspaltung der Geschichte gelang Otto Hahn (1879–1968) und Fritz Straßmann (1902–1980) im Jahr 1938 durch den Neutronenbeschuss von Uran.
Der
erste primitiv funktionierende Kernreaktor CP-1 wurde 1942 durch
Enrico Fermi (1901–1954) unter der Tribüne des Sportstadiums in
Chicago ohne nennenswerten Strahlenschutz in Betrieb genommen. Auf einem Haufen schichtete er sechs Tonnen
Uran mit 36,6 Tonnen angereichertem
Uranoxid und 315 Tonnen Graphit als Moderator in mehreren
Schichten übereinander.
Die Regelung der Kernreaktion erfolgte mit Stäben aus
Cadmium. Nach dem Experiment wurde der Reaktor abgebaut und als CP-2 im Argonne National Laboratory südwestlich von Chicago neu aufgebaut. Dieser Reaktor außerhalb der Stadt war besser abgeschirmt und leistungsfähiger, er diente als Versuchsreaktor bis 1954.
Die im Zweiten Weltkrieg aus Deutschland nicht emigrierten Wissenschaftler versuchten ebenfalls eine geregelte Kernreaktion in Gang zu bringen. Als Moderator zum Abbremsen der Neutronen verwendeten die Deutschen Schweres Wasser (Deuteriumoxid) statt Graphit. Unter der Führung von Walther Gerlach (1889–1979) und unter Aufsicht von Werner Heisenberg (1901–1976) starteten sie diesen Versuch im Jahre 1944 in Haigerloch. Er misslang, vermutlich hatten sie aufgrund der Kriegsverluste zu wenig Schweres Wasser oder zu wenig Uran zur Verfügung. Das Isotop Uran-235 lässt
sich durch den Beschuss mit Neutronen spalten. Dabei entstehen durch verschiedene
Möglichkeiten unterschiedliche Spaltprodukte und Energie, deren Freisetzung
sich aus den Massedefekten berechnen lässt. Bei der vollständigen
Umsetzung von Uran-235 lassen sich aus einem Kilogramm Material maximal
22,5 Millionen Kilowattstunden Energie gewinnen.
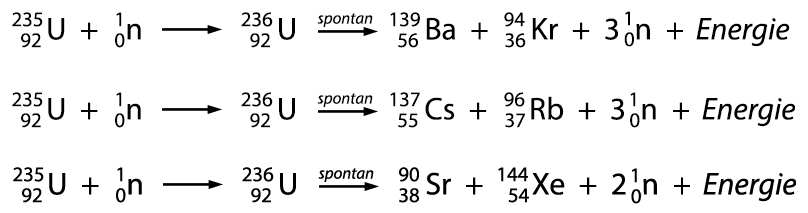 Die bei der Spaltung
frei werdenden Neutronen verursachen selbst wieder eine Spaltung, so
dass eine Kettenreaktion eintritt. Zur kontrollierten Regelung der
Kettenreaktion im
Reaktor eines Kernkraftwerks können Steuerstäbe aus Bor oder
Cadmium hineingefahren werden. Die Steuerstäbe absorbieren die
Neutronen und begrenzen die Kettenreaktion. Um die Uran-Brennstäbe
herum
befinden sich Moderatoren, die die frei werdenden Neutronen abbremsen,
damit sie von den Uran-235-Atomen besser eingefangen werden können.
Die frühen Reaktoren verwendeten Graphit als Moderator. Auch der
Reaktor in Tschernobyl war ein solcher Typ. Bei der Katastrophe 1986
brannten die Graphit-Stäbe und erzeugten eine Menge Rauch, der die
radioaktiven Spaltprodukte in hohe Luftschichten transportierte und
somit in großen Teilen Europas verteilte. Heute werden
hauptsächlich Leichtwasserreaktoren eingesetzt.
Die radioaktiven Spaltprodukte
werden im Katastrophenfall wie Tschernobyl oder Fukushima freigesetzt. Die gesundheitlichen
Auswirkungen des Isotops Caesium-137 sind katastrophal. Die Halbwertszeit der Isotope
ist unterschiedlich. Während die gasförmigen Edelgase wie Krypton-94
und Xenon-144 in die Atmosphäre gelangen und dort relativ schnell
zerfallen, kontaminieren vor allem Caesium-137 und Strontium-90 den Boden
auf längere Zeit, da beide Isotope eine Halbwertszeit von etwa 30
Jahren besitzen. Darüber hinaus entsteht in Kernreaktoren eine Vielzahl
anderer radioaktiver Spaltprodukte. Treffen Neutronen beispielsweise auf
Uran-239 entsteht Plutonium-239 mit einer Halbwertszeit von 24110 Jahren. Plutonium ist in Mischoxid-Brennelementen
(MOX) mit etwa sieben Prozent Anteil enthalten.
Ab 1943 begann das „Manhattan Projekt“ in Los Alamos im US-Bundesstaat New Mexiko unter der Leitung von J. Robert Oppenheimer (1904–1967). Es endete mit dem Bau der ersten Atombombe, die am 16. Juli 1945 in der Wüste von New Mexiko als „Trinity“-Test gezündet wurde. Diese erste jemals gezündete Kernwaffe nannte man „The Gadget“, sie beruhte auf dem Prinzip einer Plutonium-Implosionsbombe. Das Plutonium dafür wurde nicht in Los Alamos, sondern im geheimen Nuklearkomplex Hanford Site im Südosten des US-Bundesstaats Washington hergestellt. Die zweite Atombombe „Little Boy“ mit einem Kern aus Uran-235 wurde erst beim tatsächlichen Einsatz getestet. Sie tötete am 6. August 1945 über Hiroshima mehr als 90000 Menschen. Sie explodierte in 600 Metern Höhe mit der Wirkung von etwa 13000 Tonnen TNT und zerstörte das gesamte Stadtzentrum. Die radioaktiven Spaltprodukte verseuchten große Landstriche. Auch wenn durch die beiden Atombombenabwürfe in Hiroshima (Uran-Bombe) und am 9. August 1945 in Nagasaki (Plutonium-Implosionsbombe) der Zweite Weltkrieg beendet wurde, sind die furchtbaren Folgen dieser Bomben ein ewiges Mahnmal geblieben. An den langfristigen Folgen der Atombombenabwürfe starben bis heute weit mehr als 200000 Menschen. |
Die
Uranerze wie die Pechblende mit dem enthaltenen Uran(IV)-oxid UO2 werden
zerkleinert und durch Flotation angereichert. Mit verdünnter Schwefelsäure
und einem Oxidationsmittel erhält man eine Lösung, die Uranylsulfat UO2SO4 enthält. Durch Ionenaustauschverfahren oder durch eine Extraktion
mit organischen Lösungsmitteln wie Tributylphosphat (TBP) lassen sich
aus diesen Lösungen die Uranverbindungen isolieren. Durch die Behandlung
mit einer Lauge oder mit Ammoniak erhält man je nach Temperatur und Verfahren eine gelbe bis schwarze Mischung mit verschiedenen Uranverbindungen. Nach dem früheren Verfahren erhielt man eine gelbe Mischung, die auf dem Förderband wie ein gelber Kuchen („Yellow Cake“) aussah. Sie enthielt verschiedene Uran(VI)-Verbindungen wie Uran(VI)-oxid UO3 sowie Ammonium- oder Natriumdiuranat. Mit Salpetersäure ließ sich daraus Uranylnitrat UO2(NO)3 darstellen, das durch Glühen auf 1000 °C in Uran(V,VI)-oxid U3O8 umgewandelt wurde.
Nach dem neuen Verfahren wird Uran(IV)-oxid mit Wasserstoffperoxid zu Uranylperoxid gefällt, das danach durch Glühen zu relativ reinem Uran(V,VI)-oxid U3O8 umgewandelt werden kann. Heute enthält das Zwischenprodukt überwiegend Uran(V,VI)-oxid. Dieses ist schwärzlich und nicht gelb, man nennt es daher „Black Yellow Cake“. Durch eine Reduktion mit Wasserstoff entsteht Uran(IV)-oxid UO2. Dieses wird mit Fluorwasserstoff-Dampf zu Uran(IV)-fluorid UF4 umgesetzt. Daraus lässt sich durch Reduktion mit Magnesium oder Calcium schließlich das reine Uran darstellen. Diese Reaktion ist exotherm, sie findet in Stahltiegeln statt, am Boden sammelt sich das Uran und bildet einen metallischen Kern. Man erhält eine Mischung von drei natürlichen Uran-Isotopen. Für eine Verwendung in Atomreaktoren muss das spaltbare Isotop U-235 von 0,7 Prozent auf drei bis vier Prozent angereichert werden. Als Verfahren zur Anreicherung kommen das Gaszentrifugen-Verfahren oder das Trenndüsen-Verfahren zur Anwendung. Beim Arbeiten mit Zentrifugen wird bei jedem Arbeits-Schritt das Uran-235 um etwa zehn Prozent angereichert. Diese Zahl variiert je nach Stand der Technik. Nach dem ersten Schritt ist das natürliche Uran also nur auf einen Anteil von 0,77 Prozent Uran-235 angereichert. Dies erklärt den gewaltigen Aufwand, der betrieben werden muss, um einen dreiprozentigen Anteil von Uran-235 zu erhalten.
Im neueren Silex-Verfahren wird die gasförmige Uranverbindung Uranhexafluorid mit Lasern beschossen, dabei werden Uran-235-Moleküle zu Schwingungen angeregt, so dass man sie von den Uran-238-Molekülen trennen kann. Dieses Verfahren ermöglicht eine erheblich schnellere und bessere Trennung der Uranisotope im Vergleich zur Arbeit mit Zentrifugen. [Lit 83] |
Uran
und Urandioxid dient in Kernreaktoren als Kernbrennstoff. Dabei benötigt
man angereichertes Uran mit einem Uran-235-Anteil von mindestens drei Prozent. Schwerwasserreaktoren
können auch mit natürlichem Uran betrieben werden. Kernwaffenfähiges
Material benötigt einen Anteil von 60 bis 90 Prozent des Isotops U-235.
Das abgereicherte Uran, das bei der Anreicherung von U-235 zurückbleibt, dient zur Herstellung von sehr harten Stählen in der Flugzeugindustrie oder für Spitzen von panzerbrechender Uranmunition. Abgebrannte Brennstäbe dienen im Schnellen Brüter zur Herstellung
von spaltbarem Plutonium. Der Zusatz von färbenden
Uransalzen in der Glasindustrie ist heute verboten. In allen Fällen
ist die Verwendung von Uran mit großen Umweltproblemen verbunden: Ausgebrannte, nicht wieder aufbereitbare Brennstäbe müssen jahrtausendlang in Salzbergwerken sicher gelagert werden. Uranmunition kann in Kriegsfällen ganze Landstriche radioaktiv verseuchen.
|
| Lise
Meitner und Otto Hahn Radioaktive Zerfallsreihen |