Legt man verschiedene
Metallstäbe in eine Kupfer(II)-sulfat-Lösung, bildet sich auf
dem Eisenstab ein Kupferspiegel, während auf dem Silberstab keine
Kupferabscheidung stattfindet. Auf allen Metallen, die besser oxidierbar
sind als Kupfer, scheidet sich in einer Kupfer(II)-salz-Lösung Kupfer
ab. Bei Metallen, die schlechter oxidierbar sind als Kupfer, beispielsweise
bei den Edelmetallen Silber oder Gold, findet keine Kupferabscheidung statt.
Das Phänomen kann
anhand des elektrochemischen Potenzials mit Hilfe
einer Redoxreaktion erklärt werden. Taucht
man einen Zinkstab in die Kupfer(II)-salz-Lösung, werden die Zink-Atome
unter Elektronenentzug zu Zink2+-Ionen
oxidiert, die in Lösung gehen, während den Kupfer2+-Ionen
in der Lösung die Elektronen zugeführt werden, sie werden zu Kupfer-Atomen reduziert. Deshalb scheidet sich Kupfer auf dem Zinkblech ab.
| Oxidation (Elektronenentzug) | Zn |
| Reduktion (Elektronenzufuhr) | Cu2+ +
2 e− |
| Gesamtreaktion | Zn + Cu2+ |
Oxidation und Reduktion
bilden bei dieser elektrochemischen Reaktion jeweils ein Redoxpaar.
Der Zinkstab löst sich nach und nach auf, daher ist die Kupferschicht
auf dem Stab nicht lange beständig. Die Reaktion verläuft solange,
bis die gesamte Kupfer(II)-sulfat-Lösung verbraucht ist. Als Produkte
liegen Kupferpulver und die (farblose) Zink(II)-sulfat-Lösung vor,
der Zinkstab erscheint wie „angefressen“. Hätte man genügend
Kupfer(II)-sulfat-Lösung zur Verfügung, würde sich der Zinkstab
vollständig auflösen.
Wenn man ein Kupferblech in eine Silber(I)-nitrat-Lösung stellt, scheidet sich elementares Silber auf dem Kupferblech ab, da das Elektrodenpotenzial vom Silber im Verhältnis zum Kupfer positiv ist. Kupfer ist daher im Vergleich zum Silber ein unedleres Metall.
Wenn man ein Kupferblech in eine Silber(I)-nitrat-Lösung stellt, scheidet sich elementares Silber auf dem Kupferblech ab, da das Elektrodenpotenzial vom Silber im Verhältnis zum Kupfer positiv ist. Kupfer ist daher im Vergleich zum Silber ein unedleres Metall.
| Oxidation (Elektronenentzug) | Cu |
| Reduktion (Elektronenzufuhr) | 2 Ag+ +
2 e− |
| Gesamtreaktion | Cu + 2 Ag+ |
Auch die Ionen der Nichtmetalle
bilden Redoxpaare. Leitet man Chlorgas in eine Kaliumbromid-Lösung,
bildet sich elementares Brom.
Die Brombildung ist an den braunen Dämpfen erkennbar. Leitet man dagegen
Brom in eine Kaliumchlorid-Lösung, findet gar keine Reaktion statt.
Man kann es so erklären: Chlor-Atome haben eine höhere Elektronegativität als Brom-Atome, daher entziehen
sie den Bromid-Ionen gerne Elektronen.
| Oxidation (Elektronenentzug) | 2 Br− |
| Reduktion (Elektronenzufuhr) | Cl2 +
2 e− |
| Gesamtreaktion | Cl2 +
2 Br− |
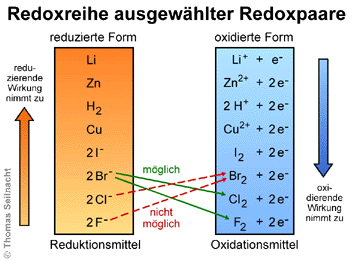
Führt man entsprechende
Experimente mit allen Redoxpaaren von Metallen oder Nichtmetallen durch,
kann man eine Redoxreihe oder eine elektrochemische
Spannungsreihe aufstellen. In der linken Spalte stehen alle Atome
oder Ionen, die Elektronen abgeben können und oxidierbar sind, also
alle Reduktionsmittel wie die Metall-Atome und die Nichtmetall-Anionen.
In der rechten Spalte stehen alle Oxidationsmittel, beispielsweise die
Nichtmetall-Atome und die Metall-Kationen. Aufgrund der Redoxreihe kann
man bestimmen, ob eine Reaktion überhaupt stattfindet. Grundsätzlich
sind keine Reaktionen von links nach rechts aufsteigend möglich. Ein
Reduktionsmittel kann nur mit einem Oxidationsmittel reagieren, wenn dieses
stärker ist und dem Reduktionsmittel die Elektronen entziehen kann.
Die Ionen der Edelmetalle
nehmen eher Elektronen auf wie die Ionen der unedlen Metalle. Die Stärke
zur Fähigkeit Elektronen aufzunehmen, kann man mit dem Redoxpotenzial
oder dem Normalpotenzial bezogen auf eine Standard-Wasserstoffelektrode
messen. Das Redoxpotenzial des Redoxpaares Cu / Cu2+ + 2e−
beträgt +0,34 Volt, das des Redoxpaares Zn / Zn2+ +
2e− wird mit −0,76 Volt angegeben. Aus diesem Wissen aufbauend
kann man die Spannung errechnen, wenn man aus den jeweiligen Redoxpaaren
eine galvanische Zelle baut.
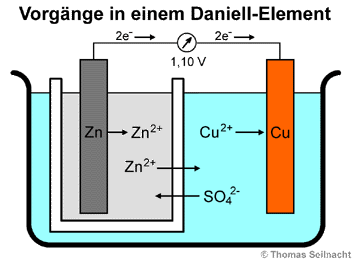
Eine galvanische Zelle besteht aus zwei Halbzellen mit unterschiedlichen Elektroden und Elektrolyten, sie wandelt chemische Energie in elektrische Energie um. Beim Daniell-Element bestehen die Halbzellen aus einer Kupferelektrode, die in Kupfer(II)-sulfatlösung taucht und aus einer Zinkelektrode, die in Zinksulfatlösung taucht. Damit zwischen den beiden Zellen Ladungen ausgetauscht werden können, benötigt es ein Rohr mit einer leitfähigen Salzlösung als Verbindungsbrücke für die Elektrolyte, sowie eine leitfähige Verbindung zwischen den Elektroden. So erhält man eine chemische Batterie. In leistungsfähigen Daniell-Elementen besteht die Verbindung der Elektrolytlösungen aus einem porösen Diaphragma aus Ton oder Steingut. Beim unten abgebildeten Daniell- Element sitzt ein Zinkblech in einem porösen Tiegel, der mit Zinksulfat-Lösung gefüllt ist. Im äußeren Glasbehälter sitzt die Kupferelektrode in einer Kupfer(II)-sulfat-Lösung:
Eine galvanische Zelle besteht aus zwei Halbzellen mit unterschiedlichen Elektroden und Elektrolyten, sie wandelt chemische Energie in elektrische Energie um. Beim Daniell-Element bestehen die Halbzellen aus einer Kupferelektrode, die in Kupfer(II)-sulfatlösung taucht und aus einer Zinkelektrode, die in Zinksulfatlösung taucht. Damit zwischen den beiden Zellen Ladungen ausgetauscht werden können, benötigt es ein Rohr mit einer leitfähigen Salzlösung als Verbindungsbrücke für die Elektrolyte, sowie eine leitfähige Verbindung zwischen den Elektroden. So erhält man eine chemische Batterie. In leistungsfähigen Daniell-Elementen besteht die Verbindung der Elektrolytlösungen aus einem porösen Diaphragma aus Ton oder Steingut. Beim unten abgebildeten Daniell- Element sitzt ein Zinkblech in einem porösen Tiegel, der mit Zinksulfat-Lösung gefüllt ist. Im äußeren Glasbehälter sitzt die Kupferelektrode in einer Kupfer(II)-sulfat-Lösung:
Die entstehende Spannung
von 1,10 Volt lässt sich mit Hilfe des Normalpotenzials
der Redoxpaare berechnen. Das Normalpotenzial des Redoxpaares Zn / Zn2+
+ 2e− ist mit −0,76 Volt niedriger als das des Paares
Cu / Cu2+ + 2e− mit +0,34 Volt.
Die Differenz beträgt 1,10 Volt. Der Lösungsdruck
ist beim unedleren Zink größer als beim Kupfer, es gehen viel
mehr Zink-Ionen in Lösung als Kupfer-Ionen in der anderen Halbzelle.
Die frei werdenden Elektronen wandern zur Kupferelektrode und reagieren
mit den Kupfer-Ionen in der Elektrolytlösung zu elementarem Kupfer.
Der Ladungsaustausch zwischen den Elektrolyten findet durch die Reaktion
der Zn2+-Ionen mit den SO42−-Ionen über
das Diaphragma statt.
Aus galvanischen Zellen
lassen sich Batterien, Akkumulatoren
oder Brennstoffzellen bauen. Schaltet man sie
in Reihe, addieren sich die Spannungen. Werden sie parallel geschaltet,
addiert sich die verfügbare Stromstärke. Bei dem oben abgebildeten
Daniell-Element erhält man bei 1,10 Volt eine Stromstärke von
etwa 0,1 Ampere.
Die Vorgänge, die
in einer galvanischen Zelle stattfinden, kann man auch umkehren: Bei der
Elektrolyse werden mit Hilfe elektrischer
Energie chemische Reaktionen erzwungen. So kann man aus elektrisch leitfähigen
Salzlösungen chemische Elemente in einer Stoffzerlegung (Analyse)
gewinnen. Bei der Elektrolyse
einer Zinkiodid-Lösung erhält man elementares Zink und elementares
Iod. Bei der Schmelzflusselektrolyse
von Zinkbromid wird das Salz so stark erhitzt, bis es schmilzt. In
der Schmelze befinden sich frei bewegliche Ionen, die eine Leitfähigkeit
ermöglichen. Beim Anlegen einer Gleichspannung entstehen an den Elektroden
Brom und Zink. Elektrolysen stellen in der chemischen Industrie bedeutende
Arbeitsverfahren zur Gewinnung von Metallen dar, beispielsweise bei der
Chlor-Alkali-Elektrolyse oder bei den Schmelzfluss-Elektrolysen
nach Downs und Hall-Hérout.
Bei der Kupfer-Raffination dient die Elektrolyse
zur Reinigung von Kupfer. Die Elektrolyse von Wasser zu Wasserstoff und
Sauerstoff spielt in der Wasserstofftechnologie
eine bedeutende Rolle.
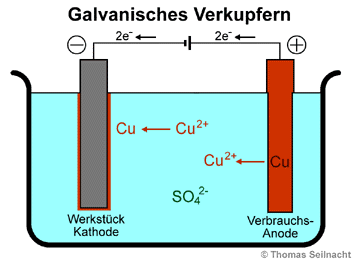
In der Galvanik
werden Metalle zum Schutz vor Korrosion elektrolytisch in einem Bad mit
anderen Metallen wie Chrom, Zink oder Kupfer überzogen. Das zu beschichtende
Werkstück wird an den Minuspol einer Gleichstromquelle als Kathode
in das Bad gehängt. Das aufzubringende Metall hängt am Pluspol
als Verbrauchs-Anode im Elektrolyt-Bad. Als Elektrolytlösung dient
immer eine Salzlösung des Anoden-Metalls. Beim galvanischen Verkupfern
wäre dies eine Kupfer(II)-sulfat-Lösung. Sobald eine Gleichspannung
angelegt ist, reduzieren die überschüssigen Elektronen am Werkstück
(Kathode) die Kupfer(II)-Ionen der Lösung zu Kupfer-Atomen. An
der Verbrauchs-Anode werden Kupfer-Atome zu Kupfer-Ionen unter Elektronenabgabe
oxidiert.
Das Rosten
ist ein Angriff von oxidierend wirkenden Stoffen wie Luftsauerstoff, Wasser
oder Säuren auf Metalle. Bei der Korrosion
reagieren Werkstoffe mit Stoffen aus der Umgebung, sie werden dabei angegriffen
und zersetzen sich. Korrosionsvorgänge können aber in kleinem
Maßstab auch an den Berührungsstellen zweier verschiedener Metalle
entstehen. Beim Gebäudebau stellen sich beispielsweise Fragen wie:
Darf man eine Kupferregenrinne zusammen mit einem Ableitungsrohr aus Zink
verbauen? Ein Experiment dient als Antwort: Stellt man einen Kupferstab
und einen Zinkstab isoliert voneinander in ein Gefäß mit verdünnter
Salzsäure, tritt nur am Zinkstab eine Gasentwicklung auf. Das Kupfer
wird von der Salzsäure zunächst nicht angegriffen. Sobald sich
aber die beiden Metallstäbe berühren, ist die Gasentwicklung
am Kupferstab zu sehen, während sie am Zinkstab zurückgeht:
Salzsäurelösung berühren, entsteht ein Lokalelement.
Film
Bei der Berührung
der beiden Metalle entsteht eine galvanische Zelle. Es fließen dabei
Elektronen vom unedleren Zink zum edleren Kupfer. Die Elektronen reduzieren
die H+-Ionen aus der sauren Lösung an der Oberfläche
des Kupfers zu Wasserstoff. Eine solche kurzgeschlossene galvanische Zelle
bezeichnet man als Lokalelement. Beim Lokalelement
werden die Oxidation und damit die Zersetzung des Zinks beschleunigt.
| Oxidation | Zn |
| Reduktion | 2 H+ +
2 e− |
| Gesamtreaktion | Zn + 2 H+ |
Zur Verhinderung von
Lokalelementen muss man einen Augenmerk auf Lötstellen,
Schweißnähte oder Verschraubungen richten, sobald Feuchtigkeit
hinzukommt.
Legierungen
wie Edelstahl oder Chromargan sind erheblich rostbeständiger als die
reinen Metalle. Will man reine Metalle einsetzen, muss man zum Schutz vor
Korrosion die Oberfläche mit einer Schutzschicht überziehen,
die den Zutritt von oxidierend wirkenden Stoffen verhindert. Es eignen
sich Einölen, Lackieren oder das Überziehen mit einer Oxidschicht.
Metalle wie Aluminium reagieren sofort mit dem Luftsauerstoff und bilden
eine sich selbst schützende Schicht aus Aluminiumoxid. Zur Verstärkung
dieser Oxidschicht werden Aluminiumgegenstände durch Eloxieren
geschützt:
In ein Elektrolysebad
mit verdünnter Schwefelsäure hängt man als Anode das zu
eloxierende Werkstück aus Aluminium und als Kathode eine Elektrode aus
Kohle, Blei oder Aluminium. Legt man eine Gleichspannung an, werden die
H3O+-Ionen der Säure an der Kathode unter Elektronenaufnahme
zu Wasserstoff und Wasser reduziert. Am Aluminium-Werkstück oxidieren
die Aluminium-Atome unter Elektronenabgabe zu Al3+-Ionen.
Diese reagieren mit dem Wasser und bilden Aluminiumoxid Al2O3.
Gleichzeitig werden wieder H3O+-Ionen frei:
| Reduktion | 6 H3O+
+ 6 e− |
| Oxidation | 2 Al |
| 2 Al3+
+ 9 H2O |
|
| Gesamtreaktion | 2 Al + 3 H2O |
Zur Verhinderung von
Korrosion werden Metalle auch mit einem edleren Metall überzogen.
Das Vergolden von elektronischen Kontakten oder der Zinnüberzug auf
Konservendosen aus Eisenblech sind Beispiele dafür. Die Schicht schützt
aber nur solange wie der Überzug intakt ist. Ist die Zinnschicht auf
den Konservendosen beschädigt, kann sich unter Wasser- oder Säureeinfluss
ein Lokalelement bilden.
Man kann aber auch ein
unedleres Metall als Korrosionsschutz aufziehen. Dies ist beim Verchromen
der Fall. Das Chrom gilt als äußerst korrosionsbeständig,
da es sofort eine schützende Oxidschicht mit dem Luftsauerstoff ausbildet
und mit anderen Metallen sehr korrosionsbeständige Legierungen eingeht.
Ein weiteres Beispiel stellt das Verzinken dar. Der Zinküberzug kann
galvanisch erfolgen oder durch Schmelztauchen
in ein flüssiges Zinkbad bei der Feuerverzinkung.
Dabei bildet sich am Übergang zwischen dem Stahl und dem Zink eine
korrosionsbeständige Legierung. Gleichzeitig dient das Zink als Opfer-Anode,
da das unedlere Zink zuerst korrodiert, bevor das Eisen oxidiert. Den gleichen
Zweck erfüllen die Opfer-Anoden aus Magnesium an großen Schiffen
oder an Pipelines.
Themenverwandte Seiten
Redoxreaktion
Normalpotenzial
Batterien und Akkumulatoren
Kupfer-Raffination
Themenverwandte Seiten
Redoxreaktion
Normalpotenzial
Batterien und Akkumulatoren
Kupfer-Raffination