- Säuren und Basen wie Salzsäure und Natronlauge können nach dem Verdünnen mit Wasser durch gegenseitige Neutralisation vernichtet und in den Abguss gegeben werden. Vorsicht bei der Verdünnung von Schwefelsäure! Gewässergefährdende Säuren oder Basen werden ebenfalls zuerst mit Wasser verdünnt und dann mit Natronlauge oder Salzsäure im Abzug vorsichtig neutralisiert. Die entstandenen Salzlösungen kommen in den Behälter G4.
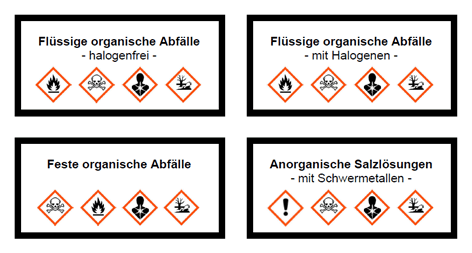
- Im Behälter für anorganische Salzlösungen mit Schwermetallen G4 sind die Salze in Wasser gelöst. Der pH-Wert muss leicht alkalisch gehalten werden (pH=8), da in sauren Lösungen bei stickstoffhaltigen Salzen Cyanwasserstoff entstehen kann.
- Achtung: Die festen organischen Abfälle im Behälter G3 sind brennbar.
- Flüssige organische Abfälle im Behälter G1 sind oft leicht entzündbar, hier muss besonders auf eine gute Ablüftung und Brandsicherheit geachtet werden, damit keine explosiven Luft-Gemisch entstehen. Halogenhaltige organische Abfälle im Behälter G2 dürften an Schulen nur in geringsten Mengen anfallen.
|
|
Für viele Stoffe und Reaktionsprodukte sind besondere Vorkehrungen notwendig:
- Metallreste und trockene Metallpulver werden in einem geschlossenen und brandsicheren Metallbehälter gesondert gesammelt und möglichst bald als Schadstoff abgegeben. Metallstäube können vor allem dann zu brennen beginnen, wenn sie feucht sind oder wenn sie fein zerteilt viel Luftkontakt haben. Niemals darf man Metallpulver wie Zink- oder Magnesiumpulver in einen Papierkorb geben, vor allem auch nicht in Spuren an einem Papier! Nicht phlegmatisiertes Zinkpulver kann sich an der Luft von selbst entzünden. Achtung: Die Phlegmatisierung – die bei der Herstellung angelegte Oxidschicht – geht verloren, wenn Zinkpulver bei einem Experiment mit einer Säure behandelt wird. Für Schulen sollten nur phlegmatisierte Metallpulver angeschafft werden, unsichere Altbestände sind einem Entsorgungsunternehmen im Originalgebinde abzugeben. Geringe Mengen feuchter Metallpulverreste, die mit Wasser reagieren, wie feuchtes Magnesium- oder Zinkpulver werden vorsichtig mit verdünnter Salzsäure zu einem löslichen Salz umgesetzt (Achtung starke Wasserstoffbildung und Erwärmung, nur im laufenden Abzug durchführen!), die Säure wird danach mit Natronlauge neutralisiert, die Salzlösungen werden im Behälter G4 entsorgt. Natrium und andere Alkalimetalle benötigen eine Spezialbehandlung.
- Anorganische Feststoffe
(ohne Metalle und ohne lösliche Salze) werden in einem
brandsicheren Behälter mit Deckel und Sandeinlage gesammelt. Kleine
Mengen brennbarer Stoffe wie Schwefel oder entzündbare
Flüssigkeiten können im laufenden Abzug vorsichtig verbrannt
werden. Für roten Phosphor sind besondere Maßnahmen notwendig.
- Fallen zum Beispiel Reste an, die pyrophor sind oder die noch eine versteckte Glut enthalten können oder bei denen eine Nachreaktion möglich ist, müssen Maßnahmen eingeleitet werden, um zu verhindern, dass der Abfallbehälter zu brennen beginnt (Maßnahmen verschieden je nach Reaktionsprodukt: zum Beispiel vollständig ausglühen, wässern, mit Salzsäure umsetzen, brandsicherer Behälter mit Sand und Deckel verwenden).
- Werden Chemikalienflaschen komplett aussortiert, sollte man die Stoffe in der Original-Flasche lassen und diese zur Entsorgung abgeben.
- Für Glasabfälle wird ein eigener Mülleimer aus Metall mit Deckel
verwendet, damit keine Glasreste zwischen Müll versteckt sind, es besteht Verletzungsgefahr für den Putzdienst!
- Abfallbehälter für Papier
im Unterrichtsraum für Chemie sollten generell von
Chemikalienabfallbehältern getrennt werden. Aber auch für
Papier-Mülleimer werden Metallbehälter mit dichtem Metalldeckel empfohlen, da
es immer wieder Personen gibt, die darin – trotz Verbot – eine Zigarette
oder Chemikalienreste entsorgen. Der verantwortlichen Lehrkraft wird dann
möglicherweise fahrlässiges Verhalten unterstellt, wenn es zu
einem Brand kommt.
- Geringe Abfall-Mengen mit Chemikalien aus
Reagenzglasversuchen, die wasserlöslich sind, kann man mit viel
Wasser verdünnt im Abfluss entsorgen; gewässergefährdende Stoffe, Stoffe
mit dem Totenkopf oder CMR-Stoffe dürfen allerdings nicht so im Abfluss entsorgt
werden.
- Stoffe, die mit anderem Abfall gefährliche Reaktionen verursachen können, müssen gesondert mit Beschriftung des Inhalts dem Entsorgungsdienst abgegeben werden.
Die Schule und der Chemieunterricht ist Vorbild für das verantwortungsbewusste Verhalten der Schüler und Schülerinnen und die sachgerechte Entsorgung von gefährlichen Stoffen. Tipps zur Chemikalienentsorgung im Haushalt findet man beispielsweise unter „Chemie im Haushalt“. Vor dem Beginn jedes Experimentes muss von den Beteiligten geklärt werden, welche Abfälle und Reste entstehen und wie diese gefahrlos entsorgt werden können. Hinweise finden sich auch im Sicherheitsdatenblatt des Lieferanten. Die nachfolgende Liste gibt Ratschläge zur Entsorgung spezieller Stoffe, einige davon dürfen heute nicht mehr an Schulen eingesetzt werden.
Ammoniumdichromat (explosionsgefährlich mit weniger als 15% Wasseranteil, krebserzeugend)
Mit Wasser anfeuchten und im Originalbehälter einem Entsorgungsunternehmen abgeben. Keine Aufbewahrung an Schulen!
Asbest und Platinasbest (krebserzeugend)
Mit dem Vermerk „enthält Asbest“ bei einem Entsorgungsunternehmen abgeben. Alte Behälter dürfen auf gar keinen Fall geöffnet oder umgefüllt werden. Als Ersatz eignet sich ein Platin-Palladium-Katalysator auf Bimsstein. Keine Aufbewahrung an Schulen, unbedingt entsorgen!
Batterien mit Quecksilber oder Akkus mit Cadmium
Batterien in Folie verpacken und einem Entsorgungsunternehmen abgeben. Derartige Batterien oder Akkus sind heute – abgesehen von wenigen Spezialanwendungen – nicht mehr erlaubt.
Brom (bildet toxische Dämpfe)
Mit Wasser verdünnen und mit Natriumthiosulfat zu Bromid reduzieren. Eine Aufbewahrung an allgemeinbildenden Schulen wird nicht empfohlen.
Calciumcarbid (bildet mit Wasser extrem entzündbares Ethin)
Reste im Abzug vorsichtig mit Wasser versetzen und das entstehende Ethin laufend mit dem Brenner abfackeln. Die anfallende Kalkmilch mit verdünnter Schwefelsäure neutralisieren, den entstehenden Gips filtrieren. Das Filtrat kann in das Abwasser, der Rückstand in den Hausmüll gegeben werden. Trockenes Calciumcarbid kann an Schulen in einem separaten Chemikalienschrank aufbewahrt werden.
Chrom(VI)-oxid (krebserzeugender Stoff)
Im Originalbehälter einem Entsorgungsunternehmen abgeben. Behälter nicht öffnen, Stoff nicht anfeuchten! Er kann mit Wasser gefährlich reagieren! Eine Aufbewahrung an Schulen ist äußerst problematisch, die Entsorgung wird empfohlen.
Cobalt(II)-chlorid und andere Cobaltsalze (krebserzeugend bei Berührung und beim Einatmen der Stäube)
Mit Wasser anfeuchten und im Originalbehälter einem Entsorgungsunternehmen abgeben. Schülerübungen mit Cobaltsalzen sind nicht erlaubt. Die Aufbewahrung an Schulen ist problematisch.
Diiodpentaoxid (setzt beim Erhitzen Iod frei und wirkt oxidierend)
Kleine Reste werden im Abzug in einem Reagenzglas durch Erhitzen mit dem Brenner vorsichtig zu Iod und Sauerstoff umgesetzt. Das Iod kann in Ethanol aufgelöst werden. Die ethanolische Iodlösung kommt zu den flüssigen, organischen Abfällen mit Halogenen.
Erdöl oder Erdölgemisch
Das natürliche Erdöl enthält viele toxische Komponenten. Dieses Erdöl darf an Schulen nicht aufbewahrt werden, da es unter anderem auch Benzol enthält. Im Chemikalienhandel für Schulen ist ein „künstliches Rohöl“ erhältlich, das von der Mineralölindustrie extra für den Destillationsversuch hergestellt wurde.
Essigsäureanhydrid (kann mit Wasser und vor allem mit Säuren und Laugen heftig reagieren)
Kleine Mengen werden im Abzug mit viel kaltem Wasser verdünnt und mit Natriumhydrogencarbonat neutralisiert. Danach gibt man die Flüssigkeit in den Behälter für Schwermetallsalzlösungen oder entsorgt sie im Abfluss. Größere Mengen müssen gesondert gesammelt werden.
Flusssäure (starke Ätzwirkung, Lebensgefahr bei Berührung und beim Einatmen)
Flusssäure gehört auf gar keinen Fall an allgemeinbildende Schulen. Beim Umgang mit Flusssäure (und mit Fluorwasserstoff) ist unbedingt eine vollständige Schutzkleidung zu tragen: Gesichtsvollschutz, Laborkittel, Gummimantel, intakte Handschuhe aus Fluorkunststoff. Nach der folgenden Vorschrift könnte man Flusssäure vernichten: Sie wird mit Wasser verdünnt, dann gibt man Natriumhydrogencarbonat zur Neutralisation zu und anschließend wird mit Calciumhydroxid zu Calciumfluorid ausgefällt. Das Produkt kann im Gefäß 4 entsorgt werden. Allerdings ist es empfehlenswert, das Vernichten von Flusssäure einem Experten zu überlassen. Gelangen Spritzer auf die Haut, besteht Lebensgefahr, auch wenn nach dem schnellen Abwaschen vorläufig keine Symptome auftreten.
Gase allgemein (Explosionsgefahr, toxische Wirkung)
Entzündbare Gase wie Methan, Ethan, Propan, Butan, Ethylen, Kohlenstoffmonooxid können im explosionsgeschützten Abzug abgefackelt oder abgesaugt werden, sofern die Gase in einer Apparatur in kleinsten Mengen kontinuierlich entstehen. Wenn sich ein explosionsfähiges Gemisch im Gefäß, im Abzug oder in einem Raum gebildet hat, darf auf gar keinen Fall eine Zündquelle angeschaltet werden. Kleinere Mengen nicht brennbarer Gase können im Abzug durch Absaugen entsorgt werden. Toxische Gase dürfen an Schulen nicht in Druckgasflaschen aufbewahrt werden.
Iodsäure und Periodsäure (oxidative Feststoffe)
Anfeuchten und in einem geschlossenem Behälter mit der Kennzeichnung „Oxidierende Flüssigkeit“ dem Sondermüll zuführen.
Kaliumchlorat (altes Kaliumchlorat ist oft verunreinigt und daher explosionsgefährlich)
Reste werden in Wasser gelöst, danach mit verdünnter Salzsäure angesäuert und mit Eisen- oder Zinkpulver zu Kaliumchlorid reduziert. Nach Umsetzung mit Natronlauge wird die Lösung im Gefäß 4 entsorgt. Frisches und sauberes Kaliumchlorat sollte an Schulen nur in Kleinmengen in einem separaten Chemikalienschrank aufbewahrt werden.
Kaliumperchlorat (starkes Oxidationsmittel)
Es wird empfohlen, den Stoff gesondert in einem Behälter zu sammeln und alsbald einem Entsorgungsunternehmen abzugeben. Von einer längeren Lagerung der Reste wird abgeraten. Frisches und sauberes Kaliumperchlorat sollte an Schulen nur in Kleinmengen in einem separaten Chemikalienschrank aufbewahrt werden.
Kaliumdichromat und Kaliumchromat (krebserzeugende Stoffe)
Mit Wasser anfeuchten und im Originalbehälter einem Entsorgungsunternehmen abgeben. Chromate könnten auch mit Natriumhydrogensulfit-Lösung (bei pH=2) zu den weniger gefährlichen Chrom(III)-salzen umgewandelt werden (2 Stunden warten). Eine Aufbewahrung an Schulen ist verboten.
Kaliumcyanid (stark toxisch, Gefahr der Freisetzung hochgiftiger Blausäuredämpfe)
Lösungen der Cyanide dürfen auf gar keinen Fall mit Säuren in Berührung kommen. Die Lösung wird auf pH=11 eingestellt und mit Kupfersulfat als Katalysator versetzt. Danach tropft man im Abzug tropfenweise 30%ige Wasserstoffperoxid-Lösung hinzu und belässt die Lösung für mindestens zwei Stunden. Dann erfolgt die Entsorgung im Gefäß 4. So könnte man das Cyanid vernichten, allerdings überlässt man die Entsorgung am besten einem Experten. Bei Hautkontakt besteht akute Lebensgefahr! Es wird davon abgeraten, Cyanide an Schulen aufzubewahren.
Kaliumpermanganat (gewässergefährdend, brandfördernd)
Anfeuchten und dicht in geschlossenem Behälter aufbewahren. Dem Sondermüll mit der Kennzeichnung „Oxidierender Feststoff“ zuführen. Kaliumpermanganat kann in Kleinmengen an Schulen aufbewahrt werden.
Natriumazid
Azide zersetzen sich mit Iod und Natriumthiosulfat in wässriger Lösung zu Stickstoff. Die gleiche Zersetzung findet auch in einer angesäuerten Nitritlösung statt. Kleine Reste können in einem Sammelbehälter in Wasser gelöst werden. Der pH-Wert muss dabei pH-neutral eingestellt werden. Azidhaltige Lösungen oder Originalbehälter werden mit der korrekten Beschriftung zur Chemikalienentsorgung gegeben. Die Aufbewahrung an Schulen wird nicht empfohlen.
Natriumfluorid und Kaliumfluorid
Diese Fluoride können mit Säuren den gefährlichen Fluorwasserstoff bilden. Kleine Mengen der Lösungen in Wasser kann man so vernichten: Die Lösung wird stark verdünnt und mit Natriumhydrogencarbonat neutralisiert, dann gibt man Calciumhydroxid hinzu. Das ausgefällte Calciumfluorid kommt in den Behälter für Schwermetallsalze, das fluoridfreie Filtrat kann ins Abwasser gegeben werden. Es wird empfohlen, lösliche Fluoride nicht an Schulen aufzubewahren.
Natriumsulfid
Im Abzug mit Natriumhypochlorit-Lösung umsetzen. Achtung, heftige
Reaktion! Mehrere Tage bei laufendem Abzug stehen lassen, dann
restliches Oxidationsmittel mit Natriumthiosulfat vernichten.
Reaktionsprodukt in den Behälter für Schwermetallsalze geben. Die Aufbewahrung an Schulen wird nicht empfohlen.
Altes
Natrium und Kalium
(Bildung exlosionsfähiger Gasgemische bei Kontakt mit Wasser)
Kleine Mengen in größere
Portionen Brennspiritus geben, bei Kalium tertiären Butanol verwenden,
3 Tage stehen lassen, wegen der Wasserstoffentwicklung nur im Abzug, nach
vollständiger Reaktion mit Wasser verdünnen und mit verdünnter
Schwefelsäure neutralisieren, dann am besten einem Entsorgungsunternehmen
abgeben. Natriumsplitter aus Versuchen können unter Einhaltung der Sicherheitsvorschriften mit Wasser zerstört werden. Das Aufbewahren von Kalium an Schulen wird nicht empfohlen.
Natrium muss frisch und oxidfrei in Paraffinöl aufbewahrt werden.
Die Natriumbestände (in Kleinmengen) sind halbjährlich zu prüfen
und eventuell zu erneuern.
Nickelsulfat und andere lösliche Nickelsalze
(krebserzeugend)
Im Originalbehälter einem Entsorgungsunternehmen abgeben. Keine
Aufbewahrung an Schulen! Dieser Stoff kann in alten Chemiekästen oder in Sets zur Kristallzüchtung enthalten sein.
Nitrate wie Kaliumnitrat
oder Natriumnitrat (brandfördernd, saure Lösungen können
im Gemisch mit anderen Stoffen im Behälter G4 die Entstehung von
Cyanwasserstoff begünstigen)
Es wird empfohlen, Nitrate jeweils gesondert zu sammeln und zur
Entsorgung zu geben. Wässrige Lösungen müssen alkalisch
gehalten werden. Geringe
Reste aus Reagenzglasversuchen können im Abfluss entsorgt werden,
wenn der Stoff nicht gewässergefährdend ist. Nitrate
können an Schulen verwendet und aufbewahrt werden. Ammoniumnitrat
darf nur in absolut reiner und trockener Form verwendet werden, es muss in einem separaten Chemikalienschrank aufbewahrt werden.
Perchlorsäure
(kann im reinen Zustand beim Erhitzen explodieren)
Anfeuchten und in einem
geschlossenem Behälter mit der Kennzeichnung „Oxidierende Flüssigkeit“ dem Sondermüll zuführen. Von einer Aufbewahrung an Schulen wird abgeraten.
Phosgen
in Gasflaschen (stark toxisch, Lebensgefahr!)
Phosgen und andere besonders
gefährliche Altlasten – zum Beispiel Gase mit Fluor-Anteilen,
Ethylenoxid oder Blausäure – dürfen nicht durch Lehrkräfte
entsorgt werden, sie sind an allgemeinbildenden Schulen verboten. Hierfür
muss ein spezialisiertes Entsorgungsunternehmen eingeschaltet werden.
Weißer
Phosphor (toxisch, selbstentzündlich an der Luft)
Im Absperrwasser und
einem Glasbehälter mit dichtem Verschluss einem Entsorgungsunternehmen
abgeben. Achtung, das Absperrwasser ist auch stark toxisch! Kleinste Mengen können zusammen mit Ethanol im Abzug verbrannt werden. Geräte, die mit weißem Phosphor
in Berührung kamen, ausglühen und sorgfältig verbrennen,
Glasgeräte mit Kaliumpermanganat spülen.
Von einer Aufbewahrung an Schulen wird dringend abgeraten.
Roter Phosphor
(bildet beim Verbrennen ätzendes Phosphorpentoxid, bildet mit
anderen Stoffen explosionsfähige Gemische, kann sich zu gelbem
Phosphor umwandeln)
Kleinste Mengen Phosphor werden in einer Porzellanschale, der etwas Alkohol
zugegeben wurde, im laufenden (und geeigneten) Abzug oder im Freien verbrannt. Der entstehende, weiße Phosphorpentoxid-Rauch
ist stark ätzend. Feuersichere Schutzhandschuhe und Schutzbrille
anziehen! Es muss geprüft werden, ob der Abzug dafür geeignet
ist. Beim Verbrennen in einem Verbrennungslöffel ist darauf zu achten, dass der
Verbrennungslöffel absolut sauber ist und niemals Schwefel oder
andere Stoffe darin enthalten waren. Diese könnten explosiv mit dem
Phosphor reagieren. Alle Geräte, die mit Phosphor in Kontakt kamen, müssen gut geglüht werden.
Danach werden sie im laufenden Abzug mit einer 5%igen
Natriumhypochlorit-Lösung gespült. Roter, verunreinigter Phosphor darf
nicht als Entsorgungsrest aufbewahrt werden, da er sich allmählich
zu gelbem Phosphor umwandeln kann.
Phosphorpentoxid (reagiert sehr heftig mit Wasser)
Kleine Mengen werden im Abzug in Kleinstportionen in einem Behälter aus Duranglas
vorsichtig mit Wasser zu Phosporsäure umgesetzt. Vorsicht, sehr
heftige Reaktion mit Spritzwirkung möglich! Dann erfolgt die
Behandlung wie mit einer Säure.
Pikrinsäure
(explosionsgefährlich mit weniger als 23% Wasseranteil)
Eine Aufbewahrung an Schulen ist verboten. Sollten noch Reste vorhanden sein, belässt man die Flasche am vorhandenen Ort und lässt sie von einem Spezialunternehmen entsorgen. Das Aufschrauben einer Flasche mit ausgetrockneten Resten kann gefährlich sein.
Quecksilber
(toxisch, vor allem die Dämpfe)
Verschüttetes Quecksilber
sorgfältig sammeln (nur mit dem im Laborbedarf erhältlichen Quecksilber-Absorptionsmittel),
dies
gilt auch bei zerbrochenen Quecksilberthermometern; mit Quecksilber
darf nur über einer Schale oder einem dichten Tablett gearbeitet
werden;
Reste von Quecksilber oder seinen Salzen dürfen keinesfalls in den
Müll oder in den Abfluss gegeben werden, dies gilt auch für
Batterien;
sie müssen gesondert gesammelt und einem Entsorgungsunternehmen
abgegeben
werden. Quecksilber kann nur unter Beachtung der Vorschriften aufbewahrt
werden: Der Behälter mit Quecksilber ist von einem zweiten, gegen Bruch gesicherten
Kunststoffbehälter
umgeben, und er steht auf einer Quecksilberwanne kippsicher in einem Schrank mit Ablüftung. Das
Set mit dem Absorptionsmittel zur Entsorgung
von Quecksilber bei Unfällen muss immer direkt daneben stehen. Das Aufbewahren von Quecksilber und
Quecksilbersalzen
an allgemeinbildenden Schulen wird nicht empfohlen. Eine Ausnahme bildet das
weniger
toxische Quecksilbersulfid.
Quecksilbersalze
wie Quecksilber(II)-chlorid oder Quecksilberoxid (toxisch)
Salze im Originalbehälter belassen und bei alten Flaschen mit
zusätzlicher Kunststoffflasche umgeben. Reste immer gesondert in
doppeltem Behälter – innen Glas, außen Kunststoff – mit
Beschriftung und Name des Stoffes sammeln, korrekte GHS-Kennzeichnung
angeben und dann einem Entsorgungsunternehmen abgeben. Ein
Absorptionsmittel für Quecksilber muss vorhanden sein, sobald
Altlasten gefunden werden oder wenn Quecksilbersalze vorrätig sind.
Dieses eignet sich auch für Quecksilbersalze
(Herstellervorschriften beachten!).
Schwefelkohlenstoff
und Ether (sehr leicht flüchtig, bilden
mit Luft explosionsfähige Gemische)
Kleinste Reste brennt man im laufenden Abzug oder im Freien vorsichtig ab. Der Abzug muss für das Arbeiten mit den beiden Stoffen geeignet sein. Es soll so experimentiert werden, dass möglichst keine Reste anfallen. Reste werden in einer Flasche mit Teflonverschluss gesammelt, beschriftet und einem Entsorgungsunternehmen abgegeben. Es darf
nur Diethylether frei von Peroxiden unter Lichtschutz in einem brandsicheren
Sicherheitsschrank aufbewahrt werden. Schwefelkohlenstoff darf nur in
Kleinmengen einzeln separiert in einem eigenen Sicherheitsschrank
aufbewahrt werden.
Silbersalze
wie Silber(I)-nitrat oder Silber(I)-oxid
und deren Lösungen
Die Silbersalze (als
Feststoffe) können in Kleinmengen unter Lichtschutz an den Schulen
aufbewahrt werden. Silber(I)oxid
kann in kleinen Mengen (1 g) durch Erhitzen zu Silber reduziert werden.
Achtung! Diese Reaktion kann auch heftig verlaufen!
Silbernitrat in wässriger
Lösung wird durch die Zugabe von Eisenspänen oder beim Erhitzen
mit Glucose zu Silber reduziert. Dann kann man die Lösung im Abguss
entsorgen. Generell wird empfohlen, Lösungen nicht aufzubewahren und
immer nur frische Ansätze zu verwenden (kleine PE-Tropfflasche mit
Alufolie umwickelt verwenden!).
Ammoniakalische Silbernitrat-Lösungen
(Tollens Reagenz, Lösungen zur Verspiegelung) dürfen auf gar
keinen
Fall aufbewahrt werden, auch nicht zur Entsorgung! Man vernichtet sie
sofort
nach dem Experimentieren durch das Zugeben von Glucose, dabei reduziert
das Silbersalz zu elementarem Silber. Nach dem Abfiltrieren wird das
Filtrat
in den Ausguss gegeben. Das Filterpapier ist gut auszuwaschen und wird
auf einem Dreifuß im Abzug verbrannt (Achtung, explosive Reaktion
möglich!), reine Silberreste werden als Feststoff entsorgt.
Generell
sind alle Gegenstände und die Unterlage nach jeder Arbeit mit
Silbersalzen
mit viel Wasser nachzuspülen. Aufgrund der komplexen Entsorgung
wird
eher davon abgeraten, an allgemeinbildenden Schulen mit Tollens Reagens
zu arbeiten. Für Verspiegelungsexperimente wird empfohlen, nicht
mehr als 3 ml Lösung in kleinen Reagenzgläsern einzusetzen.
Tetrachlorkohlenstoff
(toxisch und gewässergefährdend)
Reste im Sammelgefäß
„Halogenhaltige organische Stoffe“ entsorgen, braune oder lichtdichte Flasche
verwenden. Das Aufbewahren und Verwenden von Tetrachlorkohlenstoff an Schulen ist generell verboten.
Wasserstoffperoxid
und Lösungen
Mit viel Wasser verdünnen
und in einen geeigneten Behälter mit der Beschriftung
„Wasserstoffperoxid-Lösung“ geben. Der Behälter darf nicht fest verschlossen werden. An
einem
dunklen und kühlen Ort mit Abluftanlage aufbewahren und einem
Entsorgungsunternehmen
abgeben. Unstabilisiertes Wasserstoffperoxid neigt zur spontanen
Zersetzung, daher darf nur die stabilisierte Lösung aufbewahrt werden.
Im Schullabor sind nur Konzentrationen bis maximal 30% geeignet. Die Lagerung erfolgt in einer braunen Flasche in einem
für das Labor geeigneten Kühlschrank. Für Schülerversuche
wird empfohlen, nur Lösungen bis zu einer Konzentration von 10%
einzusetzen.