Kaliumnitrat
KNO3
CAS 7757-79-1
Kaliumnitrat
Potassium nitrate
101,103 g/mol
keine Angaben
2,105 g/cm3
+334 °C
100g H2O lösen 31,66 g (L)
keine Angaben
2,105 g/cm3
+334 °C
100g H2O lösen 31,66 g (L)
Farblose Kristalle oder kristallines, weißes Pulver
Kaliumnitrat ist kein Explosivstoff, kann aber zur Herstellung derartiger Stoffe verwendet werden (rechtlicher Hinweis). Bei Experimenten zum Schmelzen und Erhitzen von Kaliumnitrat ist neben dem obligatorischen Augen- und Brandschutz eine Schutzscheibe notwendig.
Kaliumnitrat ist auch unter der Bezeichnung „Kalisalpeter“ bekannt. Dieser kommt in der Natur in den Kalisalpeter-Lagerstätten vor. Das Mineral wird als Nitrokalit bezeichnet. Im Handel erhält man Kaliumnitrat als weißes, kristallines Pulver. Das Kaliumsalz der Salpetersäure ist an der Luft relativ beständig, es ist weniger hygroskopisch als Natriumnitrat oder andere Nitrate.

Kaliumnitrat löst sich unter Abkühlung im Wasser, wobei viel Wärme von der Umgebung aufgenommen wird. Beim Auskristallisieren der warmen, konzentrierten Lösung in einer Petrischale bilden sich langgezogene, klare Kristalle nach dem orthorhombischen System:

In warmem Wasser löst sich Kaliumnitrat bedeutend besser, so steigt die Wasserlöslichkeit des Kaliumnitrats bei einer Erwärmung der Lösung von 20 °C auf 100 °C um mehr als das Siebenfache an. Im Vergleich dazu nimmt die Löslichkeit des Natriumchlorids beim Erwärmen nur wenig zu:
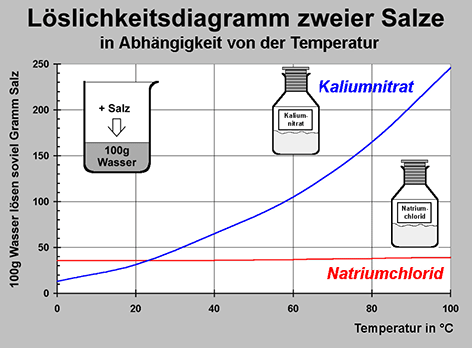
Wasserlöslichkeit (L): 100g H2O lösen Kaliumnitrat wasserfrei
Beim Erhitzen über die Schmelztemperatur wird Sauerstoff unter Bildung von Kaliumnitrit abgegeben. Eine heiße Kaliumnitrat-Schmelze reagiert heftig mit organischen Verbindungen, ebenso mit Kohle und Schwefel. Die Demonstration im schwer schmelzbaren Reagenzglas darf nur unter Einhaltung der Sicherheitsvorschriften vorgeführt werden. Es dürfen nur kleinste Portionen in die heiße Schmelze geworfen werden, Schutzbrille und Schutzscheibe sind notwendig.

Kaliumnitrat löst sich unter Abkühlung im Wasser, wobei viel Wärme von der Umgebung aufgenommen wird. Beim Auskristallisieren der warmen, konzentrierten Lösung in einer Petrischale bilden sich langgezogene, klare Kristalle nach dem orthorhombischen System:

In warmem Wasser löst sich Kaliumnitrat bedeutend besser, so steigt die Wasserlöslichkeit des Kaliumnitrats bei einer Erwärmung der Lösung von 20 °C auf 100 °C um mehr als das Siebenfache an. Im Vergleich dazu nimmt die Löslichkeit des Natriumchlorids beim Erwärmen nur wenig zu:

Wasserlöslichkeit (L): 100g H2O lösen Kaliumnitrat wasserfrei
| 0 °C |
20 °C |
40 °C |
60 °C |
80 °C |
100 °C |
| 13,25 g |
31,66 g |
63,9 g |
109,9 g |
169,0 g |
245,2 g |
Beim Erhitzen über die Schmelztemperatur wird Sauerstoff unter Bildung von Kaliumnitrit abgegeben. Eine heiße Kaliumnitrat-Schmelze reagiert heftig mit organischen Verbindungen, ebenso mit Kohle und Schwefel. Die Demonstration im schwer schmelzbaren Reagenzglas darf nur unter Einhaltung der Sicherheitsvorschriften vorgeführt werden. Es dürfen nur kleinste Portionen in die heiße Schmelze geworfen werden, Schutzbrille und Schutzscheibe sind notwendig.
Früher gewann man Kaliumnitrat aus Kalisalpeter, der in den Lagerstätten in Indien, China, Deutschland oder Ungarn abgebaut wurde. Später erfolgte die Herstellung aus Chilesalpeter. Das daraus erhaltene Natriumnitrat wurde dabei in einer heißen, wässrigen Lösung mit Kaliumchlorid umgesetzt:
Heute erhält man Kaliumnitrat vorwiegend durch die Reaktion von Salpetersäure mit Kaliumcarbonat:
NaNO3 + KCl  NaCl + KNO3
NaCl + KNO3
Heute erhält man Kaliumnitrat vorwiegend durch die Reaktion von Salpetersäure mit Kaliumcarbonat:
K2CO3 + 2 HNO3  2 KNO3 + H2O + CO2
2 KNO3 + H2O + CO2
Kaliumnitrat wird im Chemieunterricht für zahlreiche Versuche benötigt:
- Man kann damit Kältemischungen herstellen: Eine Mischung mit einem Anteil Eis und einem Anteil Kaliumnitrat kühlt auf bis zu −30 °C ab. Auch beim Mischen mit Ammoniumchlorid wird es sehr kalt.
- Bei einer Einführung in die Gefahrstoffe kann man das Prinzip eines oxidierend wirkenden Stoffes verdeutlichen: Beim Hineingeben kleiner Portionen brennbarer Stoffe in die Schmelze gibt es kleine, heftige Reaktionen.
- Die Temperaturabhängigkeit von Lösungen kann eindrücklich demonstriert werden.
- Mit Kaliumnitrat kann man Kristalle züchten.
- Verkohlungsrückstände an den Wänden von Glasgeräten können mit einer Kaliumnitratschmelze beseitigt werden.
Obwohl die Babylonier 1700 vor Christus den Salpeter bereits kannten, gab es bei den Griechen und den Römern und auch bei den Arabern keinen Hinweis mehr darauf, dass der Stoff verwendet wurde. Im 13. Jahrhundert wurde der Salpeter wieder von Roger Bacon bei der Beschreibung des Schwarzpulvers erwähnt. Der Alchimist hatte das Rezept vermutlich von chinesischen Mönchen erhalten. In China wurden bereits im Jahre 1288 Handbüchsen gefertigt. Diese hatten einen Kaliber mit 30 Millimeter Durchmesser waren 45 Zentimeter lang.
Dem Mönch Bertholt Schwarz ist daher wohl nicht die Erfindung des Schwarzpulvers zuzuschreiben. Er benutzte das aus dem Mittelalter stammende „Feuerwerkbuch“, dessen Herkunft heute nicht mehr genau geklärt werden kann. Schwarz war in Freiburg im Breisgau als Büchsenmacher tätig. Er war der Erfinder der Steinbüchse, einem kurzläufigen Geschütz, in dem eine aus Stein gefertigte Kugel mit Holzkeilen festgemacht und durch die Explosion des dahinter liegenden Pulverraums abgeschossen wurde. Bertholt Schwarz verbesserte die Zusammensetzung des Schwarzpulvers und erfand die ersten Geschütze. Schwarz wurde im Jahr 1389 auf den Befehl des Kaisers Wenzel hingerichtet.

Titelblatt des berühmten Feuerwerkbuches nach dem Druck 1529 in Augsburg.
Der Autor des Feuerwerkbuches ist heute nicht mehr bekannt. Um 1408 befand sich eine Handschrift davon in der Preußischen Staatsbibliothek. Das Buch gehörte zwischenzeitlich zu den „verbotenen Büchern“, die nicht für jedermann frei zugänglich waren. Zu Beginn des Buches werden zwölf Fragen beantwortet, die für das Herstellen von „Büchsen“ (heute würde man sagen: Schusswaffen) als grundlegend gelten:
„Die erste Frage (ist), ob das Feuer den Stein aus der Büchse treibt oder der Dunst, der von dem Feuer ausgeht. Nun sprechen etliche, das Feuer habe die Kraft, den Stein zu treiben. Ich spreche aber: der Dunst hat die Kraft, den Stein zu treiben. Ein Beispiel: Nimm ein Pfund gutes Pulver und tu das in ein sämig Weinfaß und verschließ es gut, daß kein Dunst davonkommen kann, (es sei) denn aus dem Weidloch, mit du es anzünden willst. Un so es angezündet wird, so ist das Pulver unterderhand verbrannt, und zerbricht der Dunst das Faß (...)
Die dritte Frage, ob wenig Pulver eher eine Büchse sprengt oder weiter schießt, als wenn man sie bis an den Klotz mit eingestoßenem Pulver füllt. Da sprech ich: wenn man die Büchse füllt bis an den Klotz, so mag das Feuer und der Dunst nicht genug Weite haben, den Schuß zu vollbringen, bis das Feuer einen Teil hinter sich ausgebrannt hat und der Dunst den Klotz heraussschlägt. Ist aber die Büchse den Dritteil bis an den vierten Teil (geladen), so kann das Pulver im allgemeinen auf einmal verbrennen und (dann) kann der Dunst seine Kraft vollbringen, und du schießest weiter, und die Büchse springt dann viele eher, wenn man sie füllt mit eingestoßenem Pulver bis an den Klotz“. (Textausschnitt aus dem Feuerwerkbuch, Seite 2)
Im 13. Jahrhundert erwähnte bereits Marcus Graecus im Buch Liber ignium („Buch des Feuers“) den Salpeter zur Herstellung leicht entzündlicher Mischungen. Bis zur Erfindung der Schießbaumwolle im 19. Jahrhundert war das Schwarzpulver der einzige verfügbare Explosivstoff zur Herstellung von Feuerwaffen. Salpeter wurde systematisch aus einer „nitrosen Erde“ gewonnen, die man in Viehställen und Schlachthäusern sammelte. Aus dem tierischen Urin bildete sich der chemisch gebundene Stickstoff mit Hilfe von Bakterien zu Nitrat um. Durch das Kochen der nitrosen Erde mit heißem Wasser löste sich das Nitrat, beim Eindampfen erhielt man einen braunen Rückstand, den „roten Mauersalpeter“. Dieser bestand im wesentlichen aus Calciumnitrat, das danach mit Pottasche zu Kalisalpeter umgewandelt wurde:

Mauersalpeter an einer Kellerwand.
Nach einer Filtration der Lösung und einer schrittweisen Kristallisation erhielt man den Salpeter in reiner, kristalliner Form. Zur Verbesserung der Ausbeute legt man ab dem 17. Jahrhundert Salpetergärten an. Diese bestanden aus langgestreckten Erdhaufen, die aus tierischem Dung, Kalk und Urin hergestellt wurden und vor Regen geschützt waren. Auch Menschenleichen soll man auf diese Erdhaufen geworfen haben. Nach zwei Jahren hatte sich soviel Salpeter gebildet, dass man aus sechs Kilogramm Erde ein Kilogramm Salpeter gewinnen konnte. Eine weitere Quelle war bis dahin der Mauersalpeter, der sich in den Viehställen an den Wänden gebildet hatte.
Neben der Verwendung zur Herstellung von Schießpulver diente der Salpeter schon ab dem Jahre 1300 zur Herstellung von Salpetersäure und wenig später auch als Oxidationsmittel zur Reinigung von Metallen.
Mitte des 19. Jahrhunderts begann der Import von Chilesalpeter nach Europa. Man fand ihn in der nordchilenischen Atacama-Wüste in mächtigen, ein bis zwei Meter dicken und bis zu 600 Kilometer langen Lagerstätten. Der chilenische Salpeter enthielt vor allem Natriumnitrat, das man leicht in Kaliumnitrat umwandeln konnte. Chile führte gegen Peru und Bolivien in den Jahren 1879 bis 1884 um die Lagerstätten in der Region Atacama einen Krieg. Der „Salpeterkrieg“ forderte 14000 Tote und sicherte Chile als Sieger die umfangreichen Salpetervorkommen.
Medien und Experimente
Infos zu den Nitraten
Versuche zum Thema Oxidationen
Unterrichtseinheit zu den oxidierend wirkenden Stoffen
Dem Mönch Bertholt Schwarz ist daher wohl nicht die Erfindung des Schwarzpulvers zuzuschreiben. Er benutzte das aus dem Mittelalter stammende „Feuerwerkbuch“, dessen Herkunft heute nicht mehr genau geklärt werden kann. Schwarz war in Freiburg im Breisgau als Büchsenmacher tätig. Er war der Erfinder der Steinbüchse, einem kurzläufigen Geschütz, in dem eine aus Stein gefertigte Kugel mit Holzkeilen festgemacht und durch die Explosion des dahinter liegenden Pulverraums abgeschossen wurde. Bertholt Schwarz verbesserte die Zusammensetzung des Schwarzpulvers und erfand die ersten Geschütze. Schwarz wurde im Jahr 1389 auf den Befehl des Kaisers Wenzel hingerichtet.
Titelblatt des berühmten Feuerwerkbuches nach dem Druck 1529 in Augsburg.
Der Autor des Feuerwerkbuches ist heute nicht mehr bekannt. Um 1408 befand sich eine Handschrift davon in der Preußischen Staatsbibliothek. Das Buch gehörte zwischenzeitlich zu den „verbotenen Büchern“, die nicht für jedermann frei zugänglich waren. Zu Beginn des Buches werden zwölf Fragen beantwortet, die für das Herstellen von „Büchsen“ (heute würde man sagen: Schusswaffen) als grundlegend gelten:
„Die erste Frage (ist), ob das Feuer den Stein aus der Büchse treibt oder der Dunst, der von dem Feuer ausgeht. Nun sprechen etliche, das Feuer habe die Kraft, den Stein zu treiben. Ich spreche aber: der Dunst hat die Kraft, den Stein zu treiben. Ein Beispiel: Nimm ein Pfund gutes Pulver und tu das in ein sämig Weinfaß und verschließ es gut, daß kein Dunst davonkommen kann, (es sei) denn aus dem Weidloch, mit du es anzünden willst. Un so es angezündet wird, so ist das Pulver unterderhand verbrannt, und zerbricht der Dunst das Faß (...)
Die dritte Frage, ob wenig Pulver eher eine Büchse sprengt oder weiter schießt, als wenn man sie bis an den Klotz mit eingestoßenem Pulver füllt. Da sprech ich: wenn man die Büchse füllt bis an den Klotz, so mag das Feuer und der Dunst nicht genug Weite haben, den Schuß zu vollbringen, bis das Feuer einen Teil hinter sich ausgebrannt hat und der Dunst den Klotz heraussschlägt. Ist aber die Büchse den Dritteil bis an den vierten Teil (geladen), so kann das Pulver im allgemeinen auf einmal verbrennen und (dann) kann der Dunst seine Kraft vollbringen, und du schießest weiter, und die Büchse springt dann viele eher, wenn man sie füllt mit eingestoßenem Pulver bis an den Klotz“. (Textausschnitt aus dem Feuerwerkbuch, Seite 2)
Im 13. Jahrhundert erwähnte bereits Marcus Graecus im Buch Liber ignium („Buch des Feuers“) den Salpeter zur Herstellung leicht entzündlicher Mischungen. Bis zur Erfindung der Schießbaumwolle im 19. Jahrhundert war das Schwarzpulver der einzige verfügbare Explosivstoff zur Herstellung von Feuerwaffen. Salpeter wurde systematisch aus einer „nitrosen Erde“ gewonnen, die man in Viehställen und Schlachthäusern sammelte. Aus dem tierischen Urin bildete sich der chemisch gebundene Stickstoff mit Hilfe von Bakterien zu Nitrat um. Durch das Kochen der nitrosen Erde mit heißem Wasser löste sich das Nitrat, beim Eindampfen erhielt man einen braunen Rückstand, den „roten Mauersalpeter“. Dieser bestand im wesentlichen aus Calciumnitrat, das danach mit Pottasche zu Kalisalpeter umgewandelt wurde:
Ca(NO3)2 + K2CO3  2 KNO3 + CaCO3
2 KNO3 + CaCO3
Mauersalpeter an einer Kellerwand.
Nach einer Filtration der Lösung und einer schrittweisen Kristallisation erhielt man den Salpeter in reiner, kristalliner Form. Zur Verbesserung der Ausbeute legt man ab dem 17. Jahrhundert Salpetergärten an. Diese bestanden aus langgestreckten Erdhaufen, die aus tierischem Dung, Kalk und Urin hergestellt wurden und vor Regen geschützt waren. Auch Menschenleichen soll man auf diese Erdhaufen geworfen haben. Nach zwei Jahren hatte sich soviel Salpeter gebildet, dass man aus sechs Kilogramm Erde ein Kilogramm Salpeter gewinnen konnte. Eine weitere Quelle war bis dahin der Mauersalpeter, der sich in den Viehställen an den Wänden gebildet hatte.
Neben der Verwendung zur Herstellung von Schießpulver diente der Salpeter schon ab dem Jahre 1300 zur Herstellung von Salpetersäure und wenig später auch als Oxidationsmittel zur Reinigung von Metallen.
Mitte des 19. Jahrhunderts begann der Import von Chilesalpeter nach Europa. Man fand ihn in der nordchilenischen Atacama-Wüste in mächtigen, ein bis zwei Meter dicken und bis zu 600 Kilometer langen Lagerstätten. Der chilenische Salpeter enthielt vor allem Natriumnitrat, das man leicht in Kaliumnitrat umwandeln konnte. Chile führte gegen Peru und Bolivien in den Jahren 1879 bis 1884 um die Lagerstätten in der Region Atacama einen Krieg. Der „Salpeterkrieg“ forderte 14000 Tote und sicherte Chile als Sieger die umfangreichen Salpetervorkommen.
Medien und Experimente
Infos zu den Nitraten
Versuche zum Thema Oxidationen
Unterrichtseinheit zu den oxidierend wirkenden Stoffen
© Thomas Seilnacht / Benutzerhandbuch / Lizenzbestimmungen / Impressum / Datenschutz / Literaturquellen
