|
Elektronenpaarbindung
Das Gas Sauerstoff liegt unter Normalbedingungen bei 0 °C und 1013 hPa als zweiatomiges Molekül (O2) vor. Dieses Phänomen tritt auch bei anderen gasförmigen, elementaren Stoffen wie Stickstoff (N2) und Wasserstoff (H2) auf. Die Ursache hierfür liegt im Aufbau und der Verknüpfung ihrer Atome, insbesondere an der Anordnung ihrer Valenzelektronen, die dafür verantwortlich sind, dass die Atome Verbindungen eingehen.
Beträgt die Differenz der Elektronegativität (EN) zwischen zwei Nichtmetall-Atomen weniger als etwa 1,7, so gehen diese bevorzugt eine Elektronenpaarbindung ein. Bei einer deutlich größeren Differenz wird eine Ionenbindung begünstigt. Der Wert von 1,7 stellt lediglich ein grober Richtwert dar; in der Realität existieren fließende Übergänge zwischen den Bindungsarten, die auch von weiteren Faktoren abhängen. Bei einer Elektronenpaarbindung werden die Valenzelektronen von beiden Atomen gemeinsam genutzt. Diese Bindungsart wird auch Atombindung oder kovalente Bindung genannt. Zwei Wasserstoff-Atome bilden beispielsweise ein Wasserstoff-Molekül (H2), indem sie ihre jeweils einzelnen Valenzelektronen zu einem gemeinsamen Elektronenpaar zusammentun (H-H). Dadurch erreichen beide Atome eine besonders stabile Elektronenkonfiguration. Das übergeordnete Prinzip ist das Streben nach einer Edelgaskonfiguration. Beide H-Atome erreichen für sich gesehen die Edelgaskonfiguration des Heliums, also zwei Elektronen in einer voll besetzten Schale: 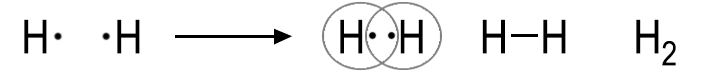 Das gemeinsam genutzte Elektronenpaar wird in der Lewis-Schreibweise durch einen Strich oder durch zwei Punkte dargestellt. Die Strukturformel H–H zeigt im Gegensatz zur Summenformel H2 die Art und Weise, wie die Wasserstoff-Atome im Molekül miteinander verknüpft sind.
Zweiatomige Moleküle bilden unter anderem Wasserstoff und Stickstoff sowie die Halogene. Beim Sauerstoff-Molekül (O2) sind die beiden Atome durch zwei Elektronenpaarbindungen miteinander verbunden; es liegt eine Doppelbindung vor. Bei einer Dreifachbindung, wie im Stickstoff-Molekül, sind die Atome durch drei Elektronenpaarbindungen miteinander verbunden. 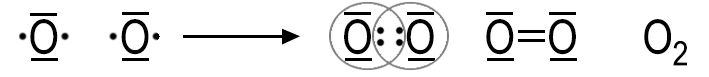

Die Oktettregel besagt, dass die Atome durch das Eingehen einer Bindung die Edelgaskonfiguration mit acht Valenzelektronen erreichen. Ausnahme: Für H-Atome gilt die Duettregel.
Fortsetzung > Polare Elektronenpaarbindung: Polarität in einem Molekül > Zwischenmolekulare Kräfte: Van-der-Waals-Kräfte – Wasserstoffbrückenbindung |