Katalysen
kommen in der Natur oft vor und lassen sich auch an alltäglichen Phänomenen
beobachten. Schneidet man eine (unbehandelte) Birne oder einen Apfel auf,
so färben sie sich an der Luft schnell braun. Dabei wirken im Obst
vorhandene Enzyme als Biokatalysatoren, die in Verbindung mit dem Luftsauerstoff
wirksam werden und die Braunfärbung einleiten.
Ein Katalysator ist ein
Stoff, der eine chemische Reaktion einleiten
kann ohne dabei selbst verbraucht zu werden. So lässt sich ein Würfelzucker
nicht ohne weiteres mit einem Streichholz anzünden. Benetzt man das
Würfelzuckerstück mit Zigarettenasche, brennt es nach einem erneuten
Zündversuch mit bläulicher Flamme. Hier wirkt die Asche als Katalysator.
Ein bedeutender Katalysator in der Technik ist das Edelmetall Platin: Wirft man in ein Knallgas-Gemisch aus Wasserstoff und Sauerstoff Platinschwamm, zündet das Gemisch. Beim Abgas-Katalysator werden die Autoabgase mit Hilfe eines platin- und rhodiumbeschichteten Keramik-Einsatzes zu unschädlichen Stoffen umgewandelt. Somit leisten Platin-Katalysatoren wirksame Beiträge zum Umweltschutz. In der chemischen Industrie erleichtern Katalysatoren den Ablauf chemischer Reaktionen. Beispiele:
Ein bedeutender Katalysator in der Technik ist das Edelmetall Platin: Wirft man in ein Knallgas-Gemisch aus Wasserstoff und Sauerstoff Platinschwamm, zündet das Gemisch. Beim Abgas-Katalysator werden die Autoabgase mit Hilfe eines platin- und rhodiumbeschichteten Keramik-Einsatzes zu unschädlichen Stoffen umgewandelt. Somit leisten Platin-Katalysatoren wirksame Beiträge zum Umweltschutz. In der chemischen Industrie erleichtern Katalysatoren den Ablauf chemischer Reaktionen. Beispiele:
-
Beim Haber-Bosch-Verfahren ermöglicht ein Gemisch aus Aluminiumoxid und Eisenoxid als Katalysator die Reaktion von Stickstoff und Wasserstoff zu Ammoniak.
-
Beim Ostwald-Verfahren ermöglicht ein Platin-Rhodium-Katalysator die Herstellung von Salpetersäure.
-
Beim Kontakt-Verfahren ermöglicht ein Vanadiumoxid-Katalysator die Reaktion von Schwefeldioxid zu Schwefeltrioxid und damit die großtechnische Herstellung von Schwefelsäure.
-
Bei der alkoholischen Gärung wirken Hefepilze als katalytische Enzyme, die Glucose zu Ethanol und Kohlenstoffdioxid umbauen.
-
Bei vielen organischen Reaktionen werden Katalysatoren eingesetzt, zum Beispiel bei der Fischer-Tropsch-Synthese, bei der Herstellung von Ethylenoxid oder von Polyethylen aus Ethen.
Den
Begriff der Auto-Katalyse verwendete erstmals
Wilhelm Ostwald. Hierbei entsteht
der Katalysator erst während der Reaktion. Gibt
man Kupfer zu konzentrierter Salpetersäure, setzt die Reaktion zunächst
nur langsam ein. Die dabei gebildeten braunen Dämpfe der Stickoxide
wirken katalytisch und beschleunigen die Reaktion dann immer mehr. Andere
Beispiele für Auto-Katalyse stellen die oszillierenden Reaktionen dar
und erstaunlicherweise auch das Wachstum der Lebewesen.
Liegen die Reaktionspartner und der Katalysator im gleichen Aggregatzustand vor, spricht man von einer homogenen Katalyse. Die Ester-Synthese ist ein klassisches Beispiel dafür. Bei unterschiedlich vorliegenden Aggregatzuständen von Katalysator und den reagierenden Stoffen handelt es sich um eine heterogene Katalyse, dies ist beim Abgas-Katalysator oder beim katalytischen Zerfall von Wasserstoffperoxid durch eine Platinmünze der Fall. Auf dem Foto ist zu erkennen, wie die Platinmünze die Sauerstoff-Entwicklung beim Zerfall des Wasserstoffperoxids anregt und die Gold- und Kupfermünze durch elektrochemische oder sogar durch autokatalytische Vorgänge „ansteckt“:
Liegen die Reaktionspartner und der Katalysator im gleichen Aggregatzustand vor, spricht man von einer homogenen Katalyse. Die Ester-Synthese ist ein klassisches Beispiel dafür. Bei unterschiedlich vorliegenden Aggregatzuständen von Katalysator und den reagierenden Stoffen handelt es sich um eine heterogene Katalyse, dies ist beim Abgas-Katalysator oder beim katalytischen Zerfall von Wasserstoffperoxid durch eine Platinmünze der Fall. Auf dem Foto ist zu erkennen, wie die Platinmünze die Sauerstoff-Entwicklung beim Zerfall des Wasserstoffperoxids anregt und die Gold- und Kupfermünze durch elektrochemische oder sogar durch autokatalytische Vorgänge „ansteckt“:
Die Wirkung eines Katalysators
kann man sich folgendermaßen vorstellen: Zwei Reaktionspartner wie Wasserstoff-Moleküle und Sauerstoff-Moleküle
würden im atomaren Zustand eine chemische Reaktion eingehen. Es fehlt
zunächst jedoch die notwendige Aktivierungsenergie
zur Trennung der Bindungen. Fügt man einen Katalysator wie Platin
hinzu, werden die Bindungen in den jeweiligen Systemen „gelockert“ oder
teilweise sogar aufgehoben und in einen Übergangszustand versetzt.
So kann auch das Aufglühen
von fein verteiltem Platin in einem Wasserstoff-Strom erklärt werden:
Platin kann Wasserstoff absorbieren. Dabei wird der molekulare Wasserstoff
teilweise in atomaren Wasserstoff umgewandelt und die chemische Reaktion
eingeleitet. An dem Prozess ist der Katalysator aktiv beteiligt, er geht
mit den Systemen Zwischenverbindungen ein, liegt aber am Ende der chemischen
Reaktion wieder unverändert vor. Die Aktivierungsenergie
einer katalytisch eingeleiteten Reaktion ist also immer niedriger als bei
einer nicht katalysierten Reaktion. Es steigt auch die Reaktionsgeschwindigkeit
bei chemischen Reaktionen.
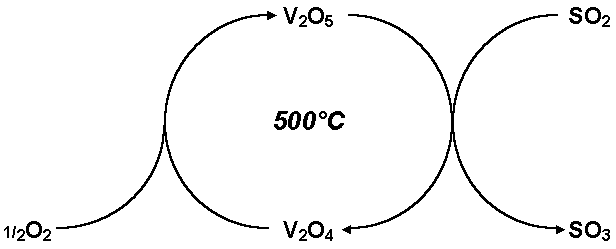
Die Entstehung von Zwischenverbindungen lässt sich auch als Kreisprozess formulieren. Dies kann an der Oxidation von Schwefeldioxid zu Schwefeltrioxid bei der Schwefelsäure-Synthese besonders gut veranschaulicht werden. In der klassischen Schreibweise wird die Reaktion mit einem Reaktionspfeil dargestellt und die Verwendung eines Katalysators über den Pfeil geschrieben:
Die Entstehung von Zwischenverbindungen lässt sich auch als Kreisprozess formulieren. Dies kann an der Oxidation von Schwefeldioxid zu Schwefeltrioxid bei der Schwefelsäure-Synthese besonders gut veranschaulicht werden. In der klassischen Schreibweise wird die Reaktion mit einem Reaktionspfeil dargestellt und die Verwendung eines Katalysators über den Pfeil geschrieben:
2 SO2 + O2
Bei der Formulierung
als Kreisreaktion wird der Tausch der Sauerstoff-Atome mit dem Vanadiumpentoxid
(V2O5) einsichtig. Derartige Kreisprozesse
finden sich auch bei der bodennahen Ozonbildung
aus Stickoxiden und bei der atmosphärischen Zerstörung
der Ozonschicht.
Historische Entwicklung der Grundlagen
Das Wort Katalyse leitet
sich vom griechischen Wort katalysis ab und bedeutet so viel wie
„Auflösung“ oder „Zersetzung“. Die Sumerer benutzten schon vor über
3000 Jahren Fermente bei der Bierherstellung. Die Techniken der alkoholischen
Gärung und der Essigsäureherstellung waren bereits in der Antike
bekannt.
Im Jahre 1742 beobachtete der schwedische Chemiker Carl Wilhelm Scheele (1742–1786) bei der Verseifung und Esterbildung durch Mineralsäuren eine Beschleunigung der Reaktion durch katalytische Effekte. 1781 entdeckte Parmentier die Spaltung von Stärke durch Mineralsäuren in Traubenzucker. Joseph Priestley (1733–1804) beschrieb im Jahre 1783 ein Experiment, bei dem er Weingeistdämpfe durch ein erhitztes Pfeifenrohr leitete und danach ein mit weißgelber Flamme brennendes Gas erhielt. Damit gelang ihm erstmals eine katalytische Dehydratisierung von Ethanol zu Ethen. Den (katalytischen) Zerfall von Wasserstoffperoxid und Ammoniak an Festkörpern beschrieb L.J. Thénard (1777–1857) in den Jahren 1813 bis 1818.
Im Jahr 1815 entwickelte der englische Chemiker Humphry Davy (1778–1829) eine Grubenlampe, die mit Benzin betrieben wurde. Die Flamme war von einem Drahtnetz umgeben. Dadurch wurde die Energie an das Drahtnetz abgegeben. Trat über dem Benzinflämmchen ein leicht bläulicher Saum auf, war der Bergmann gewarnt. Dann bestand die Gefahr einer Methangas-Explosion, die unter der Bezeichnung „schlagendes Wetter“ bekannt ist. Die Benzinflamme konnte das Methangas nicht entzünden, da außerhalb des Drahtnetzes die Entzündungstemperatur des Methangases nicht erreicht wurde.
Zwei Jahre später veröffentlichte Davy eine Arbeit, in der er über die Oxidation von Grubengasen in Anwesenheit glühender Platin-Drähte schrieb. Sein Vetter E. Davy berichtete im gleichen Jahr über die Entzündung von Alkohol-Dampf an fein verteiltem Platin. Aus dieser Entdeckung wurde „Davys Nachtlampe“ entwickelt, bei der Platin-Schwamm oder Platin-Draht über einem Spiritusbrenner befestigt war. Der heiße Draht glüht im Alkohol-Dampf auch nach dem Erlöschen der Flamme weiter:
Im Jahre 1742 beobachtete der schwedische Chemiker Carl Wilhelm Scheele (1742–1786) bei der Verseifung und Esterbildung durch Mineralsäuren eine Beschleunigung der Reaktion durch katalytische Effekte. 1781 entdeckte Parmentier die Spaltung von Stärke durch Mineralsäuren in Traubenzucker. Joseph Priestley (1733–1804) beschrieb im Jahre 1783 ein Experiment, bei dem er Weingeistdämpfe durch ein erhitztes Pfeifenrohr leitete und danach ein mit weißgelber Flamme brennendes Gas erhielt. Damit gelang ihm erstmals eine katalytische Dehydratisierung von Ethanol zu Ethen. Den (katalytischen) Zerfall von Wasserstoffperoxid und Ammoniak an Festkörpern beschrieb L.J. Thénard (1777–1857) in den Jahren 1813 bis 1818.
Im Jahr 1815 entwickelte der englische Chemiker Humphry Davy (1778–1829) eine Grubenlampe, die mit Benzin betrieben wurde. Die Flamme war von einem Drahtnetz umgeben. Dadurch wurde die Energie an das Drahtnetz abgegeben. Trat über dem Benzinflämmchen ein leicht bläulicher Saum auf, war der Bergmann gewarnt. Dann bestand die Gefahr einer Methangas-Explosion, die unter der Bezeichnung „schlagendes Wetter“ bekannt ist. Die Benzinflamme konnte das Methangas nicht entzünden, da außerhalb des Drahtnetzes die Entzündungstemperatur des Methangases nicht erreicht wurde.
Zwei Jahre später veröffentlichte Davy eine Arbeit, in der er über die Oxidation von Grubengasen in Anwesenheit glühender Platin-Drähte schrieb. Sein Vetter E. Davy berichtete im gleichen Jahr über die Entzündung von Alkohol-Dampf an fein verteiltem Platin. Aus dieser Entdeckung wurde „Davys Nachtlampe“ entwickelt, bei der Platin-Schwamm oder Platin-Draht über einem Spiritusbrenner befestigt war. Der heiße Draht glüht im Alkohol-Dampf auch nach dem Erlöschen der Flamme weiter:
|
|
J.W. Döbereiner
(1780–1849) wies im Jahre 1823 die Oxidation von Alkoholen an Platin-Schwamm
nach. Er löste Platin in Königswasser
auf und erhielt Hexachloroplatinsäure (>Film).
Durch die Zugabe von Ammoniumchlorid entstand unlösliches Platinsalmiak
(Ammoniumhexachloroplatinat), das sich beim Glühen in schwammförmiges
Platin umwandelte. Mit diesem Platin konnte er ein Knallgas-Gemisch aus
Wasserstoff und Sauerstoff
entzünden. Aus dieser Entdeckung entwickelte Döbereiner sein
berühmtes „Döbereinersches Feuerzeug“. Das Feuerzeug bestand
aus einem Glasgefäß, das mit Salzsäure
gefüllt war. Wurde ein Zink-Stab in die Säure
getaucht, entstand Wasserstoff, der beim Entweichen
des Gefäßes einen Platin-Schwamm zum Glühen brachte und
sich dadurch entzündete. Auch wenn gelegentlich ein Feuerzeug explodierte,
war es besonders bei der adligen Gesellschaft sehr beliebt.
J.W. Döbereiner
beschrieb sein Feuerzeug im Jahre 1823 in seiner Arbeit Über neu
entdeckte höchst merkwürdige Eigenschaften des Platins:
„Die in den vorletzten Experimenten sich darstellende feuererregende Tätigkeit des mit Knallgas in Berührung gesetzten Platins brachte mich auf den Gedanken, dieselbe zur Darstellung einer neuen Art von Feuerzeugen, Nachtlampen u.s.w. zu benutzen.
Ich stellte eine zahlreiche Menge von Versuchen an, um die Bedingungen auszumitteln, unter welchen das Glühendwerden des Platins mit dem kleinsten Aufwande von Wasserstoffgas erfolgt, und fand endlich, dass das gewünschte Phänomen im höchsten Glanze hervortritt, wenn man das Wasserstoffgas aus einem Gasreservoir (...) durch ein nach unten gebogenes Haarröhrchen von Glas auf den schwammigen Platinstaub, welcher in einem Uhrglase oder in einem nahe am spitzen Ende zugeschmolzenen Glastrichterchen enthalten ist, ausströmen lässt, und zwar so, das der Strom desselben sich vor der Berührung des Platins mit atmosphärischer Luft mischt (welches geschieht, wenn man das äußerste Ende des Haarröhrchens 1, 1 1/2 bis 2 Zoll hoch von dem Platin entfernt steht). Der Platinstaub wird dann fast augenblicklich rot- dann weißglühend, und bleibt dies so lange, als Wasserstoffgas ausströmt. Ist der Gasstrom stark, so entflammt das Wasserstoffgas.“
In der Folgezeit wurden katalytische Reaktionen von anderen Chemikern genauer untersucht. Das erste Patent für die Oxidation von Schwefeldioxid mit Hilfe von glühendem Platin meldete P. Phillips jr. im Jahre 1831 an. Während E. Mitscherlich (1794–1863) zunächst von „Kontakt-Reaktionen“ sprach, führte der schwedische Chemiker Jöns Jakob Berzelius (1779–1848) für diese Reaktionen im Jahre 1836 den Begriff „Katalysis“ ein. Er erkannte, dass immer ein zusätzlicher Stoff im Reaktionsgemisch vorhanden sein musste:
„Die in den vorletzten Experimenten sich darstellende feuererregende Tätigkeit des mit Knallgas in Berührung gesetzten Platins brachte mich auf den Gedanken, dieselbe zur Darstellung einer neuen Art von Feuerzeugen, Nachtlampen u.s.w. zu benutzen.
Ich stellte eine zahlreiche Menge von Versuchen an, um die Bedingungen auszumitteln, unter welchen das Glühendwerden des Platins mit dem kleinsten Aufwande von Wasserstoffgas erfolgt, und fand endlich, dass das gewünschte Phänomen im höchsten Glanze hervortritt, wenn man das Wasserstoffgas aus einem Gasreservoir (...) durch ein nach unten gebogenes Haarröhrchen von Glas auf den schwammigen Platinstaub, welcher in einem Uhrglase oder in einem nahe am spitzen Ende zugeschmolzenen Glastrichterchen enthalten ist, ausströmen lässt, und zwar so, das der Strom desselben sich vor der Berührung des Platins mit atmosphärischer Luft mischt (welches geschieht, wenn man das äußerste Ende des Haarröhrchens 1, 1 1/2 bis 2 Zoll hoch von dem Platin entfernt steht). Der Platinstaub wird dann fast augenblicklich rot- dann weißglühend, und bleibt dies so lange, als Wasserstoffgas ausströmt. Ist der Gasstrom stark, so entflammt das Wasserstoffgas.“
In der Folgezeit wurden katalytische Reaktionen von anderen Chemikern genauer untersucht. Das erste Patent für die Oxidation von Schwefeldioxid mit Hilfe von glühendem Platin meldete P. Phillips jr. im Jahre 1831 an. Während E. Mitscherlich (1794–1863) zunächst von „Kontakt-Reaktionen“ sprach, führte der schwedische Chemiker Jöns Jakob Berzelius (1779–1848) für diese Reaktionen im Jahre 1836 den Begriff „Katalysis“ ein. Er erkannte, dass immer ein zusätzlicher Stoff im Reaktionsgemisch vorhanden sein musste:
| Katalysator-Begriff J.J. Berzelius | |||
|
M. Berthelot (1827–1917)
vermutete im Jahre 1875 erstmals das Auftreten von Zwischenverbindungen
bei katalytischen Reaktionen. Den bis heute vielfach verwendeten Katalysator-Begriff
führte der deutsche Chemiker Wilhelm
Ostwald (1853–1932) in den Jahren 1894 und 1901ein:
| Katalysator-Begriff Wilhelm Ostwald | |||
|
Für seine Arbeiten
zur Katalyse erhielt Ostwald im Jahre 1909 den Nobelpreis für Chemie.
Ostwalds Arbeiten stellten auch die Grundlage für das im Jahre 1909
entwickelte Verfahren zur Ammoniaksynthese durch
Fritz Haber (1868–1934) und Carl
Bosch (1874–1940) an der BASF Ludwigshafen dar.
Weitere Informationen
Demonstrationen mit Katalysatoren
Ammoniaksynthese
Kontaktverfahren
Platin im Periodensystem
Wilhelm Ostwald
Literatur, Internetquellen
- Klaus Beneke: Zur Geschichte der Grenzflächenerscheinungen, Verlag Reinhard Knof, 1994
- Glöckner/Jansen, u.a.: Handbuch der experimentellen Chemie Sekundarbereich II – Band 8: Kinetik, Katalyse, Gleichgewichte, Aulis-Verlag 2004
- Prof. Blumes Chemie-Homepage der Universität Bielefeld: >Katalysatoren und Enzyme
- Fonds der chemischen Industrie: Katalyse, Folienserie für den Unterricht, 1996
Buch individuell erstellen: Basis-Text Katalyse


> Inhaltsverzeichnis