Methylalkohol, Methanol
CH3OH
Methylalkohol
Methanol
Methanol
Methylic alcohol
Methanol
Methanol
Molmasse
AGW
Dichte
Schmelzpunkt
Siedepunkt
Wasserlöslichkeit
Brechungsindex (20°C)
Explosionsgrenzen
Flammpunkt
Zündpunkt
AGW
Dichte
Schmelzpunkt
Siedepunkt
Wasserlöslichkeit
Brechungsindex (20°C)
Explosionsgrenzen
Flammpunkt
Zündpunkt
32,042 g/mol
100 ml/m3 (TRGS 900)
0,7909 g/cm3
−97,5 °C
+64,5 °C
vollständig mischbar
1,3288
6 bis 36 Vol.-% (Luft)
+11 °C
+464 °C
100 ml/m3 (TRGS 900)
0,7909 g/cm3
−97,5 °C
+64,5 °C
vollständig mischbar
1,3288
6 bis 36 Vol.-% (Luft)
+11 °C
+464 °C
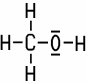
Farblose, leicht bewegliche Flüssigkeit
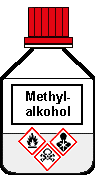
Gefahrenklassen + Kategorie
Entzündbare Flüssigkeiten 2
Akute Toxizität oral 3
Akute Toxizität dermal 3
Akute Toxizität inhalativ 3
Spez. Zielorgan-Toxizität e. Augen 1
Entzündbare Flüssigkeiten 2
Akute Toxizität oral 3
Akute Toxizität dermal 3
Akute Toxizität inhalativ 3
Spez. Zielorgan-Toxizität e. Augen 1
Das Arbeiten mit dem leicht entzündbaren und toxischen
Methylalkohol ist nur für erfahrene Praktikumsteilnehmer geeignet.
Offene Flammen sind problematisch, da der Alkohol leicht verdampft. Das
Arbeiten erfolgt in einem geeigneten und ständig laufenden Abzug.
Wird in einem weitgehend geschlossenen System mit Kleinmengen
gearbeitet, dann ist ein Abzug nicht unbedingt notwendig, es muss aber
dann eine dauerhaft laufende Raumlüftung vorhanden sein.
Schutzbrille und Schutzhandschuhe aus Neopren, Vinyl oder Fluorkautschuk
sind notwendig.
Wirkung auf den menschlichen Körper
Methylalkohol hat einen brennenden Geschmack. Die Flüssigkeit und die Dämpfe verursachen Schädigungen im Zentralnervensystem. Durch die Aufnahme von Methylalkohol kann es zu einer Schädigung der Sehnerven mit Erblindung kommen. Nieren, Herz, Leber und andere Organe werden ebenfalls geschädigt. Die Vergiftungssymptome äußern sich zunächst in Bauchkrämpfen, Schwindel, Kopfschmerzen, Übelkeit und Schwächeanfällen, später treten Sehstörungen, Atemnot und Bewusstlosigkeit auf. Die tödliche Dosis liegt zwischen 5 und 100 Milliliter Methylalkohol.

Methylalkohol ist im Vergleich zum Ethylalkohol toxisch.
Chemisch-physikalische Eigenschaften
Methylalkohol kommt in der Natur häufig vor, man findet ihn zum Beispiel in den Heracleum-Früchten, in einigen Gräsern, in den Baumwollpflanzen oder als Bestandteil etherischer Öle. Er ist der einfachste, einwertige Alkohol, er besitzt nur eine OH-Gruppe (Hydroxy-Gruppe). Er ist leicht entzündbar, mit Luft bilden sich explosionsfähige Gemische. Aufgrund der Polarität der Hydroxy-Gruppe ist Methylalkohol sehr gut wasserlöslich. Im Gegensatz zum Ethylalkohol löst er Benzin nicht. In Ethylalkohl und Diethylether löst er sich wiederum gut. Er verbrennt mit bläulicher, kaum sichtbarer Flamme zu Kohlenstoffdioxid und Wasserdampf.

Flammen beim Verbrennen von Methylalkohol (links) und Ethylalkohol (rechts).
Methylalkohol lässt sich zu Formaldehyd (Methanal) oder Ameisensäure (Methansäure) oxidieren, beispielsweise mit Kupferoxid. Mit Ammoniak NH3 erhält man unter Druck bei 400 °C und bei Vorliegen eines Aluminiumoxid-Katalysators Methylamin CH3-NH2, das ein wichtiger Rohstoff zur Herstellung von Farbstoffen, Medikamenten und Pflanzenschutzmitteln ist:
Methylalkohol hat einen brennenden Geschmack. Die Flüssigkeit und die Dämpfe verursachen Schädigungen im Zentralnervensystem. Durch die Aufnahme von Methylalkohol kann es zu einer Schädigung der Sehnerven mit Erblindung kommen. Nieren, Herz, Leber und andere Organe werden ebenfalls geschädigt. Die Vergiftungssymptome äußern sich zunächst in Bauchkrämpfen, Schwindel, Kopfschmerzen, Übelkeit und Schwächeanfällen, später treten Sehstörungen, Atemnot und Bewusstlosigkeit auf. Die tödliche Dosis liegt zwischen 5 und 100 Milliliter Methylalkohol.
Methylalkohol ist im Vergleich zum Ethylalkohol toxisch.
Chemisch-physikalische Eigenschaften
Methylalkohol kommt in der Natur häufig vor, man findet ihn zum Beispiel in den Heracleum-Früchten, in einigen Gräsern, in den Baumwollpflanzen oder als Bestandteil etherischer Öle. Er ist der einfachste, einwertige Alkohol, er besitzt nur eine OH-Gruppe (Hydroxy-Gruppe). Er ist leicht entzündbar, mit Luft bilden sich explosionsfähige Gemische. Aufgrund der Polarität der Hydroxy-Gruppe ist Methylalkohol sehr gut wasserlöslich. Im Gegensatz zum Ethylalkohol löst er Benzin nicht. In Ethylalkohl und Diethylether löst er sich wiederum gut. Er verbrennt mit bläulicher, kaum sichtbarer Flamme zu Kohlenstoffdioxid und Wasserdampf.

Flammen beim Verbrennen von Methylalkohol (links) und Ethylalkohol (rechts).
Methylalkohol lässt sich zu Formaldehyd (Methanal) oder Ameisensäure (Methansäure) oxidieren, beispielsweise mit Kupferoxid. Mit Ammoniak NH3 erhält man unter Druck bei 400 °C und bei Vorliegen eines Aluminiumoxid-Katalysators Methylamin CH3-NH2, das ein wichtiger Rohstoff zur Herstellung von Farbstoffen, Medikamenten und Pflanzenschutzmitteln ist:
CH3-OH + NH3  CH3-NH2 + H2O
CH3-NH2 + H2O
Früher wurde Methylalkohol
durch die trockene Destillation von Holz gewonnen. Im Holzdestillat
befanden sich 1,5 bis 3 Prozent Methylalkohol, 10
Prozent Essigsäure, 0,5 Prozent Aceton, Essigsäuremethylester, Acetaldehyd, Holzteer und ein Gasgemisch aus Wasserstoff, Kohlenstoffmonooxid und Ethen.
Heute erfolgt die industrielle Gewinnung
hauptsächlich in einer exothermen Gleichgewichtsreaktion
aus Synthesegas bei 400 °C und 200 Bar mit Hilfe eines ZnO/Cr2O3-Katalysators:
CO + 2 H2  CH3OH ΔHR = −119 kJ/mol
CH3OH ΔHR = −119 kJ/mol
Die chemische Industrie benötigt Methanol zur Herstellung von Formaldehyd, Methylamin und Ether,
sowie für andere organische Produkte.
Methylalkohol eignet sich auch als Lösungsmittel
für Lacke und Firnisse oder als Treibstoff und
Benzinersatz. Früher wurde er als Raketentreibstoff verwendet.
Heute wird er in der Weltraumfahrt zur Füllung
von Brennstoffzellen benötigt.
Weitere Infos
Alkohole als Stoffgruppe in der organischen Chemie
Weitere Infos
Alkohole als Stoffgruppe in der organischen Chemie
© Thomas Seilnacht / Benutzerhandbuch / Lizenzbestimmungen / Impressum / Datenschutz / Literaturquellen