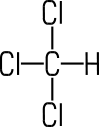
Chloroform CHCl3
 Teflonverschluss |
Flüssigkeit |
Molmasse 119,378 g/mol AGW 0,5 ml/m3 (TRGS 900) Schmelzpunkt −63,3 °C Siedepunkt +61,2 °C Dichte 1,4890 g/cm3 Wasserlöslichkeit Konz. bei 25 °C 8,0 g/l Brechungsindex (20°C) 1,4459 |
| Piktogramm GHS 06 GHS 08 Gefahr |
Gefahrenklassen
+ Kategorie Akute Toxizität oral 4 Akute Toxizität inhalativ 3 Karzinogenität 2 Reproduktionstoxizität 2 Ätz-/Reizwirkung auf die Haut 2 Schwere Augenschäd./-reizung 2 Spez. Zielorgan-Toxizität w. 1 (ZNS, Nieren, Leber) |
HP-Sätze (siehe Hinweis) H 302, 315, 319, 331, 351, 361D, 372 (ZNS, Nieren, Leber) P 261, 280.1–4,6,7, 361, 309+310, 403+233 Entsorgung G 2 |
| Dt. Bezeichnung (Synonyme) |
Engl. Bezeichnung (Synonyme) |
|
| CAS 67-66-3 | Trichlormethan Chloroform |
Trichloromethane Chloroform |
Hinweise
für Schulen: Chloroform darf an Schulen nicht
aufbewahrt werden. Alte Bestände sind
umgehend einem Entsorgungsunternehmen abzugeben. Bei Wärmeeinwirkung oder mit Sauerstoff entstehen Phosgen und Chlorwasserstoff. Chloroform steht im Verdacht Krebs zu erzeugen. Die
akute Vergiftung äußert sich zum Beispiel in Kopfschmerzen,
Übelkeit oder Schwindel. Eine beginnende Bewusstlosigkeit meldet
sich durch Schmerzunempfindlichkeit oder durch Schläfrigkeit an.
Schäden am Zentralnervensystem sind möglich. Bei der wiederkehrenden Aufnahme besteht
die Gefahr einer Leberschädigung.
Eigenschaften Chloroform oder
Trichlormethan ist eine schwere, farblose und süßlich
riechende Flüssigkeit, die in Wasser wenig löslich ist. In
Ethanol, Ether und Benzin ist sie gut
löslich. Auch Fette und Öle lösen sich leicht
darin auf. Die Flüssigkeit verdunstet leicht, sie ist aber nicht brennbar.
Bei
Kontakt mit Alkalimetallen, Fluor, reinem Sauerstoff, mit Metallpulvern
und mit vielen weiteren brennbaren Stoffen besteht Explosionsgefahr. Das Entstehen von Phosgen wird bei der Laborchemikalie durch eine 1%ige Ethanol-Zugabe verhindert.
Vier Chloralkane im Vergleich: Chlormethan ist gasförmig, Dichlormethan, Trichlormethan und Tetrachlormethan sind flüssig. |
Herstellung Trichlormethan ist ein Halogenkohlenwasserstoff. Es kann durch eine direkte Chlorierung von Methan erhalten werden. Dabei entstehen in einer mehrstufigen
Substitutionsreaktion bei etwa 450 °C die verschiedenenen
Chlormethane. Eine andere Möglichkeit ist die Herstellung aus
Chlorkalk oder Natriumhypochlorit und Aceton in alkalischer Lösung. Dabei entsteht Trichlormethan und Essigsäure:
2 H3C-CO-CH3 + 3 Cl2 |
Verwendung Trichlormethan
ist ein sehr gutes, nicht brennbares Lösungsmittel für
organische
Stoffe. Aufgrund der hohen Toxizität wird es heute dafür nur
noch selten verwendet. Früher diente es als Ausgangsprodukt
für die Herstellung der heute verbotenen FCKW,
der Fluorchlorkohlenwasserstoffe. Die chemische Industrie benötigt
es heute noch zur Herstellung organischer Stoffe, zum Beispiel für
Triphenylmethan-Farbstoffe. Im 19. Jahrhundert war Chloroform wie Diethylether ein bedeutendes Narkotikum bei chirurgischen Operationen. Aufgrund der
Nebenwirkungen verwendet man heute andere Narkotika, beispielsweise
Flurane oder Lachgas.
|