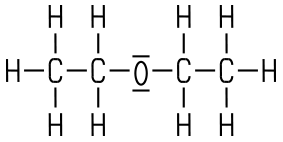
Diethylether
C4H10O
Diethylether
Ethoxyethan
Ethoxyethan
Diethyl ether
Ethoxyethane
Ethoxyethane
Molmasse
AGW
Dichte
Schmelzpunkt
Siedepunkt
Wasserlöslichkeit
Brechungsindex (20°C)
Explosionsgrenzen
Flammpunkt
Zündpunkt
AGW
Dichte
Schmelzpunkt
Siedepunkt
Wasserlöslichkeit
Brechungsindex (20°C)
Explosionsgrenzen
Flammpunkt
Zündpunkt
74,121 g/mol
400 ml/m3 (TRGS 900)
0,7135 g/cm3
−116,22 °C
+34,4 °C
Konz. bei 20 °C 69 g/l (K)
1,3526
1,9 bis 36 Vol.-% (Luft)
−45 °C
+180 °C
400 ml/m3 (TRGS 900)
0,7135 g/cm3
−116,22 °C
+34,4 °C
Konz. bei 20 °C 69 g/l (K)
1,3526
1,9 bis 36 Vol.-% (Luft)
−45 °C
+180 °C
Klare, farblose und leicht bewegliche Flüssigkeit
Teflonverschluss, braune Flasche

Gefahrenklassen + Kategorie
Entzündbare Flüssigkeiten 1
Akute Toxizität oral 4
Spez. Zielorgan-Toxizität e. ZNS 3
Entzündbare Flüssigkeiten 1
Akute Toxizität oral 4
Spez. Zielorgan-Toxizität e. ZNS 3
Von Schülerversuchen mit Diethylether ist abzuraten. Bei Laborpraktika in höheren Schulen sind die Teilnehmer ausführlich über die Gefahren zu informieren. Es bilden sich beim Umfüllen oder Öffnen der Flasche sehr schnell explosive Ether-Luft-Gemische. Es sollten an Schulen nur kleine Mengen aufbewahrt werden. Etherdämpfe sind schwerer als Luft, sie sinken an den Boden. Es ist auf eine gute Raumlüftung zu achten. Beim Arbeiten sind stets Schutzbrille und Schutzhandschuhe zu tragen. Es darf nur peroxidfreier Diethylether kühl unter Lichtschutz in einem feuersicheren Schrank unter Verschluss bei laufender Entlüftung aufbewahrt werden.
Wirkung auf den menschlichen Körper
Diethylether hat eine relativ niedrige Geruchsschwelle. In der Literatur wird aber eine sehr große Bandweite angegeben, so dass diese Einstufung vorläufig nicht zuverlässig vorgenommen werden kann. Der Autor riecht schon Etherkonzentrationen unterhalb 1 ppm. Allerdings gibt es wohl auch Personen, die selbst die hundertfache Konzentration noch nicht riechen. Daher ist das keine sichere Einstufung zur Beurteilung der Arbeitssicherheit. Der Arbeitsplatzgrenzwert liegt bei 400 ppm. Etherdämpfe wirken beim Einatmen betäubend, man wird müde und schläfrig. Schwindel setzt bereits bei 2000 ppm ein [Lit. DFG]. Enthält die Atemluft etwa vier Volumenprozent Diethylether, tritt tiefe Narkose ein. Während der Narkose wird das Zentralnervensystem gelähmt, Bewusstsein und Schmerzempfindlichkeit schwinden. Die Atmung und der Blutkreislauf wird dagegen nicht wesentlich gehemmt. Allerdings ist die Narkose mit Ether nicht ohne Risiko, eine Verabreichung der doppelten Menge oder teilweise auch von nur wenig mehr kann eine tödliche Atemlähmung verursachen. Daher werden heute andere Narkosemittel eingesetzt.
Chemisch-physikalische Eigenschaften
Die zu den Ethern gehörende, süßlich riechende Flüssigkeit verdunstet aufgrund ihres niedrigen Siedepunktes bei Zimmertemperatur sehr rasch. Diethylether ist ein sehr gutes Lösungsmittel und eignet sich daher im Labor als Extraktionsmittel. Er löst sich in Alkohol, Benzol, Chloroform, Salzsäure und mischt sich auch mit Schwefel, Phospor, Iod, sowie mit Ölen und Fetten. Die Wasserlöslichkeit ist nicht besonders gut, da das Ethermolekül im Gegensatz zu Ethanol nur wenig polar ist.
Mit Luft bilden Etherdämpfe hochexplosive Gemische, die sich bereits beim sehr niedrigen Zündpunkt von +175 °C entzünden. Etherdämpfe sind schwerer als Luft, sie sammeln sich daher in Bodennähe. Füllt man Ether in eine schräg nach unten verlaufende Rinne, so laufen die Dämpfe darin nach unten. Gibt man zwei bis drei Milliliter Diethylether auf einen Wattebausch und legt diesen in eine Apparatur mit Trichter und Schlauch, dann kriechen die Etherdämpfe rasch durch den Schlauch nach unten und entzünden sich an der Kerze bei der Schlauchöffnung. Eine blaue Flamme saust durch den Schlauch nach oben. Die Flamme erreicht den noch feuchten Wattebausch und entzündet diesen. Derartige Versuche sind relativ riskant, da sich hierbei schon gefährliche Ether-Luft-Gemische bilden können. Man darf nur mit geringsten Mengen arbeiten, der getränkte Wattebausch wird in einem verschlossenen Becherglas transportiert, die Vorratsflasche befindet sich gut verschlossen in einem Abzug.


Beim Schütteln lädt sich Diethylether elektrostatisch auf, daher dürfen größere Mengen nur unter elektrischer Erdung umgefüllt werden. Bei längerem Aufenthalt an Luft und Licht oxidiert Diethylether allmählich von selbst zu hochexplosiven Peroxiden, die sich zu Acetaldehyd, Essigsäure und Estern zersetzen. Daher muss er gut verschlossen in braunen Flaschen aufbewahrt werden. Vor einer Destillation ist unbedingt auf das Vorhandensein von Peroxiden zu überprüfen, zum Beispiel mit einer Kaliumiodid-Lösung erfolgt dann Iodabscheidung. Die Peroxide können durch Zugabe von Eisen(II)-salzen oder durch Triphenylphosphin zerstört werden.
Diethylether hat eine relativ niedrige Geruchsschwelle. In der Literatur wird aber eine sehr große Bandweite angegeben, so dass diese Einstufung vorläufig nicht zuverlässig vorgenommen werden kann. Der Autor riecht schon Etherkonzentrationen unterhalb 1 ppm. Allerdings gibt es wohl auch Personen, die selbst die hundertfache Konzentration noch nicht riechen. Daher ist das keine sichere Einstufung zur Beurteilung der Arbeitssicherheit. Der Arbeitsplatzgrenzwert liegt bei 400 ppm. Etherdämpfe wirken beim Einatmen betäubend, man wird müde und schläfrig. Schwindel setzt bereits bei 2000 ppm ein [Lit. DFG]. Enthält die Atemluft etwa vier Volumenprozent Diethylether, tritt tiefe Narkose ein. Während der Narkose wird das Zentralnervensystem gelähmt, Bewusstsein und Schmerzempfindlichkeit schwinden. Die Atmung und der Blutkreislauf wird dagegen nicht wesentlich gehemmt. Allerdings ist die Narkose mit Ether nicht ohne Risiko, eine Verabreichung der doppelten Menge oder teilweise auch von nur wenig mehr kann eine tödliche Atemlähmung verursachen. Daher werden heute andere Narkosemittel eingesetzt.
Chemisch-physikalische Eigenschaften
Die zu den Ethern gehörende, süßlich riechende Flüssigkeit verdunstet aufgrund ihres niedrigen Siedepunktes bei Zimmertemperatur sehr rasch. Diethylether ist ein sehr gutes Lösungsmittel und eignet sich daher im Labor als Extraktionsmittel. Er löst sich in Alkohol, Benzol, Chloroform, Salzsäure und mischt sich auch mit Schwefel, Phospor, Iod, sowie mit Ölen und Fetten. Die Wasserlöslichkeit ist nicht besonders gut, da das Ethermolekül im Gegensatz zu Ethanol nur wenig polar ist.
Mit Luft bilden Etherdämpfe hochexplosive Gemische, die sich bereits beim sehr niedrigen Zündpunkt von +175 °C entzünden. Etherdämpfe sind schwerer als Luft, sie sammeln sich daher in Bodennähe. Füllt man Ether in eine schräg nach unten verlaufende Rinne, so laufen die Dämpfe darin nach unten. Gibt man zwei bis drei Milliliter Diethylether auf einen Wattebausch und legt diesen in eine Apparatur mit Trichter und Schlauch, dann kriechen die Etherdämpfe rasch durch den Schlauch nach unten und entzünden sich an der Kerze bei der Schlauchöffnung. Eine blaue Flamme saust durch den Schlauch nach oben. Die Flamme erreicht den noch feuchten Wattebausch und entzündet diesen. Derartige Versuche sind relativ riskant, da sich hierbei schon gefährliche Ether-Luft-Gemische bilden können. Man darf nur mit geringsten Mengen arbeiten, der getränkte Wattebausch wird in einem verschlossenen Becherglas transportiert, die Vorratsflasche befindet sich gut verschlossen in einem Abzug.
Diese Demonstration kann nur von erfahrenen Fachkräften durchgeführt werden.
Film erhältlich auf >DVD
Film erhältlich auf >DVD
Beim Schütteln lädt sich Diethylether elektrostatisch auf, daher dürfen größere Mengen nur unter elektrischer Erdung umgefüllt werden. Bei längerem Aufenthalt an Luft und Licht oxidiert Diethylether allmählich von selbst zu hochexplosiven Peroxiden, die sich zu Acetaldehyd, Essigsäure und Estern zersetzen. Daher muss er gut verschlossen in braunen Flaschen aufbewahrt werden. Vor einer Destillation ist unbedingt auf das Vorhandensein von Peroxiden zu überprüfen, zum Beispiel mit einer Kaliumiodid-Lösung erfolgt dann Iodabscheidung. Die Peroxide können durch Zugabe von Eisen(II)-salzen oder durch Triphenylphosphin zerstört werden.
Erhitzt man Ethanol im Überschuss mit Schwefelsäure auf etwa 130 °C, entstehen in einer säurekatalysierten Kondensation Diethylether und Wasser:
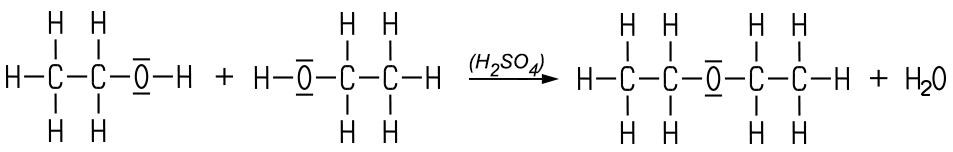
Wasserreste werden mit Calciumchlorid und Natrium entfernt. Als toxisches Nebenprodukt entsteht Diethylsulfat. Das Verfahren ist zwar technisch einfach durchführbar, es liefert aber eine relativ geringe Ausbeute. In der chemischen Industrie fällt Diethylether als Nebenprodukt bei der Gewinnung von Ethanol durch Hydratisierung aus Ethen an. Diese Quelle ist das bedeutendste Gewinnungsverfahren für Diethylether.
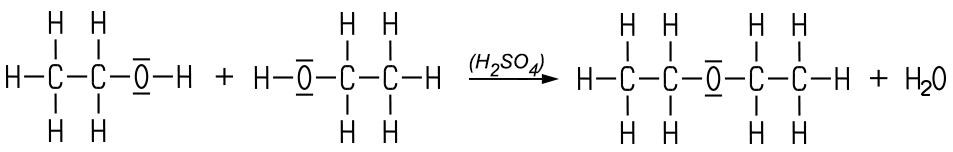
Wasserreste werden mit Calciumchlorid und Natrium entfernt. Als toxisches Nebenprodukt entsteht Diethylsulfat. Das Verfahren ist zwar technisch einfach durchführbar, es liefert aber eine relativ geringe Ausbeute. In der chemischen Industrie fällt Diethylether als Nebenprodukt bei der Gewinnung von Ethanol durch Hydratisierung aus Ethen an. Diese Quelle ist das bedeutendste Gewinnungsverfahren für Diethylether.
In der Medizin war Ether seit dem Jahr 1846 ein wichtiges Narkotikum. Aufgrund vieler Nebenwirkungen nach dem Aufwachen aus der Narkose ist diese Anwendung heute nicht mehr gebräuchlich. Weit verbreitet war auch die Verwendung als Rauschmittel, beispielsweise in alkoholischen Getränken. Diethylether ist ein gutes Lösungs- und Extraktionsmittel für Öle, Fette, Harze, Riechstoffe und Farben. Er wird zum Beispiel für die Herstellung medizinischer Tinkturen und bei chemischen Synthesen benötigt. Zusammen mit Ethanol dient Ether zum Gelatinieren von Schießbaumwolle, die zur Herstellung von Gewehrpatronen eingesetzt wird. Ether ist auch in Starthilfesprays für Verbrennungsmotoren enthalten.
Weitere Infos
Ether als Stoffgruppe in der organischen Chemie
Weitere Infos
Ether als Stoffgruppe in der organischen Chemie
© Thomas Seilnacht / Benutzerhandbuch / Lizenzbestimmungen / Impressum / Datenschutz / Literaturquellen