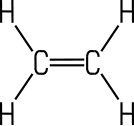
Ethen, Ethylen
C2H4
Ethen
Ethylen
Ethylen
Ethene
Ethylene
Ethylene
28,053 g/mol
keine Angaben
1,2611 g/l (Gas, 0° C, 1013 hPa)
(Ethylen zu Luft = 0,98)
−169,15 °C
−103,8 °C
Konz. bei 25 °C 0,134g/l
2,7 bis 36 Vol.-% (Luft)
+450 °C
keine Angaben
1,2611 g/l (Gas, 0° C, 1013 hPa)
(Ethylen zu Luft = 0,98)
−169,15 °C
−103,8 °C
Konz. bei 25 °C 0,134g/l
2,7 bis 36 Vol.-% (Luft)
+450 °C
Farbloses Gas

Gefahrenklassen + Kategorie
Entzündbare Gase 1
Gase unter Druck, verdicht. Gas
Spez. Zielorgantox. (e. ZNS) 3
Entzündbare Gase 1
Gase unter Druck, verdicht. Gas
Spez. Zielorgantox. (e. ZNS) 3
Für Schulen sind im Laborhandel Druckgasdosen mit dem reinen Gas erhältlich. Es gibt Entnahmeventile, die an verschiedenen Flaschen angeschraubt werden können. Ethen-Luftgemische explodieren heftiger wie Ethan-Luftgemische. Schutzbrillen sind von allen Beteiligten beim Arbeiten mit Gasen zu tragen.
Chemisch-physikalische Eigenschaften
Das farblose Gas riecht schwach süßlich und ist wenig toxisch, wirkt aber beim Menschen in höheren Konzentrationen narkotisierend und erstickend. In den Pflanzen fungiert es als Hormon, das das Wachstum im Keimstadium beeinflusst. Ethylen löst sich nur wenig in Wasser, es ist etwas besser löslich in Aceton, Ethylalkohol und Benzol und gut löslich in Diethylether. Das Gas brennt mit rußender, leuchtender Flamme und bildet mit Luft explosionsfähige Gemische.

Ethylen ist ein ungesättigter Kohlenwasserstoff, daher addiert es aufgrund seiner Doppelbindung gerne Wasserstoff oder Halogene an sein Molekül. Diese Reaktion kann auch als Nachweisreaktion für das Vorhandensein von ungesättigten Verbindungen, von Doppel- und Dreifachbindungen in organischen Stoffen herangezogen werden.

Beim Einleiten von Ethylen in Brom wird dieses aufgebraucht.
Die Durchführung dieser Demonstration an Schulen ist problematisch.
Film erhältlich auf >DVD
Setzt man Ethen hohem Druck und hohen Temperaturen aus und gibt man Spuren von reinem Sauerstoff zu, dann entsteht Hochdruck-Polyethen. Der Sauerstoff bildet Radikale und wirkt als Initiator, so dass das Ethen zu langen Ketten polymerisiert:
Weiterführende Infos zum Molekülbau
Hybridorbitalmodell beim Ethylen nach Linus Pauling
Das farblose Gas riecht schwach süßlich und ist wenig toxisch, wirkt aber beim Menschen in höheren Konzentrationen narkotisierend und erstickend. In den Pflanzen fungiert es als Hormon, das das Wachstum im Keimstadium beeinflusst. Ethylen löst sich nur wenig in Wasser, es ist etwas besser löslich in Aceton, Ethylalkohol und Benzol und gut löslich in Diethylether. Das Gas brennt mit rußender, leuchtender Flamme und bildet mit Luft explosionsfähige Gemische.
Ethylen ist ein ungesättigter Kohlenwasserstoff, daher addiert es aufgrund seiner Doppelbindung gerne Wasserstoff oder Halogene an sein Molekül. Diese Reaktion kann auch als Nachweisreaktion für das Vorhandensein von ungesättigten Verbindungen, von Doppel- und Dreifachbindungen in organischen Stoffen herangezogen werden.
Beim Einleiten von Ethylen in Brom wird dieses aufgebraucht.
Die Durchführung dieser Demonstration an Schulen ist problematisch.
Film erhältlich auf >DVD
Setzt man Ethen hohem Druck und hohen Temperaturen aus und gibt man Spuren von reinem Sauerstoff zu, dann entsteht Hochdruck-Polyethen. Der Sauerstoff bildet Radikale und wirkt als Initiator, so dass das Ethen zu langen Ketten polymerisiert:
CH2=CH2 + CH2=CH2  -CH2-CH2-CH2-CH2-
-CH2-CH2-CH2-CH2-
Weiterführende Infos zum Molekülbau
Hybridorbitalmodell beim Ethylen nach Linus Pauling
Im Labor ist Ethylen durch Erhitzen von Ethanol mit konzentrierter Schwefelsäure oder mit Phosphorsäure zugänglich. Möglich ist auch eine Eliminierungsreaktion von Dichlorethan und Zink. In der Industrie gewinnt man das Gas durch thermisches Cracken von Ethan oder von Kohlenwasserstoffgemischen. Mit Hilfe dieses Verfahrens kann aus Rohbenzin Ethen und auch Propen gewonnen werden:
H3C-CH3  H2C=CH2 + H2
H2C=CH2 + H2
Ethylen ist eines der wichtigsten Zwischenprodukte der Erdölchemie. Die künstliche Herstellung von Ethanol ist zum Beispiel eine Hydratisierung, die unter Hitze, hohem Druck und mit Phosphorsäure gelingt:
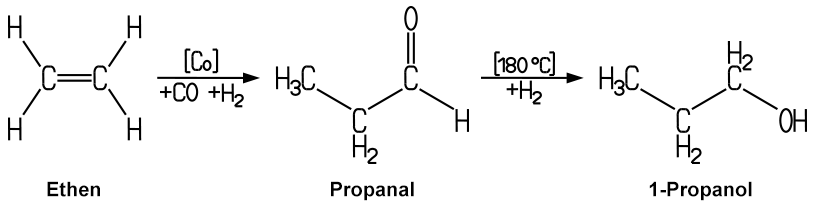
Bei der Oxosynthese lagert sich Kohlenstoffmonooxid und Wasserstoff an Ethen an.
Weitere Infos und Medien
Kohlenwasserstoffe als Stoffgruppe in der organischen Chemie
C2H4 + H2O  C2H5OH
C2H5OH
Außerdem dient Ethylen zur Herstellung der Kunststoffe Polyethen, Polyvinylchlorid und Polystyrol. Auch Ethylenoxid wird aus Ethen dargestellt. Ethylen ist ein wichtiger Grundstoff zur Herstellung von Schädlingsbekämpfungsmitteln, es kann aber auch zur Herstellung chemischer Waffen wie Senfgas missbraucht werden. Bei der Oxidation des Ethens zu Acetaldehyd und bei der Oxosynthese von Propanol und Propanal wird ebenfalls Ethylen benötigt.

Bei der Oxosynthese lagert sich Kohlenstoffmonooxid und Wasserstoff an Ethen an.
Weitere Infos und Medien
Kohlenwasserstoffe als Stoffgruppe in der organischen Chemie
© Thomas Seilnacht / Benutzerhandbuch / Lizenzbestimmungen / Impressum / Datenschutz / Literaturquellen