|
Nur für Lehrkräfte geeignet
Inhalt
Didaktische Bemerkungen Demonstration 1 Rolle des Sauerstoffs bei Verbrennungen Demonstration 2 Flammenwerfer aus Mehlstaub Demonstration 3 Zündpunkt und Fettbrand Demonstration 4 Flammpunkt – Das Löschen von brennenden Flüssigkeiten Demonstration 5 Das Löschen mit Wasser und mit Schaum Demonstration 6 Metallbrand Zusammenfassung Schon die Demonstrationen
bei der Einführung des Themas Oxidation
zeigten, dass der Sauerstoff bei
Verbrennungen notwendig ist. Für die Feuerwehr spielt nicht nur die
Sauerstoffzufuhr bei einem Brand eine Rolle, sondern auch der Zerteilungsgrad
und die Art des Brennstoffs. Bevor wirksame Maßnahmen zur Brandeindämmung
vorgeführt werden, sollen zunächst Möglichkeiten aufgezeigt
werden, um ein Feuer zu verstärken. Mit Hilfe dieses Wissens gelingt
es, Feuerlöschmaßnahmen auszuarbeiten.
Über ein Gespräch wird gemeinsam mit den Schülern erarbeitet, wie ein Pfadfinder im Wald ein Feuer anmacht. Bei dem Gespräch werden die Regeln zum Feueranmachen genannt: Zuerst kommt das Papier, dann werden die dünnen Hölzer über das Papier gelegt und zum Schluss baut man ein „Zelt“ mit den dickeren Hölzern. Das Anbrennen kann durch Hineinblasen beschleunigt werden. Noch nachhaltiger ist es, wenn man dies alles mit den Schülern selbst im Schulhof ausprobiert und die Gründe über mögliche Hindernisfaktoren diskutiert. Ein Büschel Holzwolle
wird zunächst auf dem Tisch auf einer feuersicheren Unterlage verbrannt.
Dann füllt man einen Standzylinder oder einen großen Erlenmeyerkolben
aus Duranglas (Weithals 1000 ml) mit reinem Sauerstoff und einen zweiten
mit reinem Kohlenstoffdioxid aus der Gasflasche (>Demonstrationen
mit Sauerstoff). Beim Zylinder mit reinem Sauerstoff wird der Boden
mit einer Schutzschicht aus Quarzsand bedeckt. Alternativ zur Holzwolle
könnte auch eine brennende Kerze verwendet werden.
Beobachtungen:
Es wird gezeigt, dass die Holzwolle oder die
Kerze im reinen Sauerstoff viel schneller und mit hellerer Flamme abbrennt
und im Kohlenstoffdioxid die Flamme erstickt.
Didaktische Hinweise: Zu der Demonstration kann der Hinweis erfolgen, dass beim Autogenschweißen mit einem Brenngas und mit reinem Sauerstoff gearbeitet wird. Beim Schneidbrennen erreicht man bei Wasserstoff-Sauerstoff-Gemischen sogar eine Temperatur von mehr als 2500 °C. Ein mit Wasserstoff und Sauerstoff betriebener Daniellscher Hahn erreicht ebenfalls diese Temperatur.
Zuerst wird den Schülern
eine Packung Mehl gezeigt und behauptet, dass man damit einen Sprengstoff
herstellen könne. Die Schüler sollen Vermutungen äußern,
wie das funktionieren könnte. Im Anschluss liest man den Zeitungsbericht
einer Mehlstaubexplosion vor und führt erst danach die Demonstration
durch.

Man nimmt ein Glasrohr
von mindestens 50 cm Länge und 3 cm Dicke und füllt das hintere
Ende auf einer Länge von 10 cm mit Mehl. Das Rohr sollte nicht gestopft
voll sein, damit noch Luft über das Mehl streichen kann und es sich
gut zerteilt. Am besten gelingt es, wenn man feine Speisestärke nimmt
und diese vorher im Trockenschrank gut trocknet. Am
Ende des Tisches stellt man einen Gasbrenner auf und entzündet die
Gasflamme. Dann bläst man vom vorderen Ende her kräftig durch
das Glasrohr, so dass sich das Mehl fein zerstäubt. Die Demonstration
kann auch mit verschiedenen anderen brennbaren Stoffen durchgeführt
werden, zum Beispiel mit Bärlappsporen, um zu zeigen, dass nicht jeder Brennstoff
gleich reagiert. Es ist aber unbedingt darauf zu achten, dass man beim
Einatmen der Atemluft nicht versehentlich den Staub ansaugt. Der eingeatmete
Staub kann die Atemwegsorgane reizen, es empfiehlt sich, diesen Versuch
nicht von Schülern vorführen zu lassen, sondern die Demonstration
selbst gut zu üben. Bestimmte
Holzstaubsorten gelten als krebserzeugende Arbeitsstoffe, daher sollte man Holzstaub generell nicht verwenden.
Beim Verwenden von Bärlappsporen muss unbedingt darauf geachtet
werden, dass diese nicht versehentlich angesaugt werden.
Beobachtungen:
Das zerteilte Mehl verbrennt in einer großen
Stichflamme.
Variationen: Zunächst wird gezeigt, dass ein dickes Stück Holz nur schwer anzündbar ist. Selbst wenn es anfänglich brennt, geht die Flamme wieder aus, das Stück glimmt lediglich weiter. Holzspäne dagegen lassen sich bereits mit einem Streichholz entzünden, sie brennen gut, da mehr Sauerstoff hinzukommt und die Verbrennung wesentlich schneller abläuft.
Nun füllt man einen
großen Salzstreuer mit sorgfältig getrockneten Bärlappsporen
und streut dieses in eine Kerzenflamme. Dabei kann schon eine Stichflamme
entstehen, daher sind bei dieser Vorführung dicke Lederhandschuhe
und eine Schutzbrille zu tragen. Bei den Lehrmittelverlagen ist ein Silo
aus Glas oder aus Plexiglas zur Durchführung von Mehlstaubexplosionen
erhältlich. Ein solches Gerät lässt sich auch selbst bauen.
Durch einen seitlich unten angesetzten Schlauch wird ein kräftiger
Luftstrom in einen kleinen Behälter geblasen, der mit dem Staub gefüllt
ist. Dadurch zerteilt sich der Staub und wird durch die brennende Kerze
im Silo entzündet. Da die Kerze selbst Sauerstoff verbraucht, sollte
sie erst unmittelbar vor der Versuchsdurchführung mit einem langen
Gasanzünder angezündet werden. Die Mehlstaubexplosion im Modell-Silo
gelingt am besten mit Druckluft, aber auch durch Blasen von Atemluft durch
den angesetzten Schlauch. Reiner Sauerstoff darf auf gar keinen Fall
verwendet werden!
GBU Deutschland docx pdf SB Schweiz docx pdf Besondere Sicherheitshinweise:
Der Versuch mit dem Fettbrand kann nur durchgeführt werden, wenn ausreichend Brandschutz gewährleistet
ist. Es muss geprüft werden, dass die Stichflamme keine brennbaren Stoffe in der Umgebung, im Abzugsrohr
oder an der Decke, wo sich möglicherweise Dämmstoffe befinden,
entzünden kann. Der Sicherheitsabstand für die Zuschauer beträgt
fünf Meter. Der entstehende Rauch darf sich nicht im Raum verteilen. Das Tragen der Schutzbrille ist wie bei allen Demonstrationsversuchen notwendig. Schutzhandschuhe aus Leder, die über den Unterarm reichen, sollten bereitliegen.
Diese Demonstration zeigt durchaus realistisch, welche Gefahren in der Küche oft lauern. In einem feuersicheren Abzug – mit einer genügenden Höhe und einer brandsicheren Ablüftung – setzt man einen kleinen Metalltiegel aus Edelstahl mit 3 cm Durchmesser auf ein Tondreieck, das sich auf einem Dreifuß befindet, und füllt ihn 1 cm hoch mit Kokosfett. Wird der Tiegel mit Hilfe einer Universalklemme in ein Stativ gespannt, ist unbedingt darauf zu achten, dass die Klemme aus Edelstahl besteht, da sie sonst durchschmilzt. Dann stellt man einen Brenner darunter, so dass die nicht leuchtende Flamme mit voller Kraft den Tiegel erhitzt. Gleichzeitig wird den Schülern eine Geschichte erzählt: „Stellt euch vor, einem Freund von mir ist neulich folgendes passiert: Er war für mehrere Tage alleine im Haushalt und musste selbst kochen. Er wollte sich in der Küche ein Steak braten und gab dazu in die Bratpfanne etwas Fett und stellte diese auf den Herd. Gerade in diesem Moment läutete das Telefon im anderen Raum, und er ging in das Wohnzimmer. Am anderen Ende der Leitung war sein Freund, der ihm von großen Problemen erzählte...“ (Hier werden Probleme geschildert, zum Beispiel eine Trennung von der Freundin oder Geldnöte; je nach Dauer des gleichzeitig ablaufenden Versuchs. Sobald das Fett sich von alleine entzündet hat, fährt man mit der Geschichte fort.) „Plötzlich hörte er ein Geräusch in der Küche und rannte sofort hinüber. Das Fett in der Pfanne brannte lichterloh. Was machte er also, um den Brand zu löschen? Er nahm eine Schüssel mit Wasser und goss das Wasser in die Pfanne...“ An dieser Stelle nimmt man den Brenner weg und spritzt dann wenig Wasser mit einer Spritzflasche durch eine an einem Stativ befestigte, lange Glasröhre aus sicherer Entfernung (!) in das brennende Fett.
Beobachtungen:
Das Fett entzündet sich nach einer Weile
von alleine. Beim Löschversuch mit Wasser flammt das Feuer in einer
riesigen Stichflamme auf, wobei große Hitze von dem brennenden Fett
ausgeht. Selbst nach diesem „Löschversuch“ ist das brennende Fett
noch nicht gelöscht. Man demonstriert nun, wie man es richtig macht
und deckt den Tiegel mit einer Keramikplatte ab. Der Abzug wird sofort
geschlossen (oder ist schon geschlossen), damit sich die bildenden, giftigen
Dämpfe nicht im Raum verteilen.
Theorie: Viele Stoffe entflammen auch ohne Flamme, sobald eine bestimmte Temperatur überschritten wird. Voraussetzung dafür ist der Zugang zu Luftsauerstoff. In einem geschlossenen Raum entflammen diese Stoffe dagegen nicht. Beim Zündpunkt (Zündtemperatur) entzünden sich Stoffe in Gegenwart von Luft von selbst, ohne dass eine Zündquelle vorliegt.
Auf einer feuersicheren
Unterlage und einem brandsicheren Tisch werden in eine kleine
Porzellanschale mit fünf Zentimer Durchmesser aus einem kleinen
Benzinfläschchen 20 ml Benzin (Siedepunkt
40 bis 65 °C) gegeben. Die Benzinflasche wird verschlossen und in sicherer Entfernung deponiert. Dann zündet man mit einem brennenden Holzspan.
Schutzbrille, Schutzhandschuhe aus Leder verwenden, Kopf fernhalten! Dabei sollen die Schüler darauf achten, in welcher Höhe über
dem Flüssigkeitsspiegel bereits eine Zündung stattfindet. Nun
unternimmt man einen „Löschversuch“ und spritzt mit der Spritzflasche
kräftig Wasser in die Schale, so dass das Benzin über die Wand
herausschwappt. Nach diesem erfolglosen Versuch, zeigt man, wie man es
richtig macht und deckt die Schale mit einer Keramikplatte oder einer Löschdecke
ab (Sauerstoffentzug).
Beobachtungen: Das Benzin verteilt sich auf dem Tisch und brennt weiter. Der Brand hat sich wesentlich ausgebreitet. Theorie: Nach DIN V 14011 ist der Flammpunkt die niedrigste Temperatur, bei der sich über einem Stoff ein zündfähiges Dampf-Luft-Gemisch bildet (genormt auf 1013 mbar Luftdruck). Besonders problematisch sind wasserunlösliche Stoffe mit hohem Dampfdruck und einem niedrigen Flammpunkt. Durch den Dampfdruck verdampfen Stoffe auch unterhalb des Siedepunktes. Stoffe mit hohem Dampfdruck wie Diethylether verdampfen zum Beispiel besonders gut. Nach dem GHS werden die entzündbaren Flüssigkeiten je nach Flammpunkt und Siedepunkt einer Kategorie zugeordnet.
Flüssigkeiten oder
Stoffgemische wie Benzin, die sich nicht mit Wasser vermischen lassen,
schwimmen aufgrund ihrer geringeren Dichte auf dem Wasser, so dass sich
der Brand bei einem Löschversuch mit Wasser noch ausdehnt. Wasserlösliche
Flüssigkeiten könnten theoretisch mit Wasser gelöscht werden.
Doch meistens kann das bei einem Brand nicht von der Feurwehr schnell unterschieden
werden.
Variationen: Mit geeigneten Stoffen kann man eine Flammpunktbestimmung vorführen. Ein kleiner Porzellantiegel mit fünf Zentimeter Durchmesser wird auf eine Ceranplatte im Vierfuß gestellt und mit Lampenöl oder Heizöl gefüllt, so dass ein Thermometerfühler gerade noch eintauchen kann. Wird ein Alkoholthermometer verwendet, empfiehlt sich der Einsatz eines Thermometers mit einem Temperaturbereich von bis zu 200 °C. Aber auch ein digitaler Thermometer zur Demonstration lässt sich verwenden. Quecksilberthermometer sollten im Schulversuch auf gar keinen Fall eingesetzt werden. Nun erhitzt man die Ceranplatte von unten mit dem Brenner und heizt das Öl langsam hoch. Gleichzeitig wird im Sekundenabstand mit der Flamme eines Gasanzünders über die Flüssigkeit gewedelt.
Beobachtungen:
Bei einer bestimmten Temperatur entzündet
sich das Öl. Oft brennt das Öl zunächst mit einer kleinen,
fast unsichtbaren Flamme, bevor die Flamme beim weiteren Heizen immer
größer wird. Beim Lampenöl liegt der Flammpunkt zwischen
60 und 80 °C, beim Heizöl darüber.
Hinweis:
Der hier gezeigte Apparaturaufbau entspricht
nicht der genormten Anordnung zur Bestimmung des Flammpunktes. Hierfür
müsste der Thermometer und die Flamme bei jedem Anstieg um 1 °C
herausgenommen und wieder neu in die Flüssigkeit eingeführt werden,
damit die Geräte die Bestimmung nicht beeinflussen. Außerdem
ist der Abstand von der Flamme zur Flüssigkeit genau festgelegt. Daher
misst man mit der oben gezeigten Anordnung in der Regel einen zu hohen Flammpunkt.
a) Löschen mit Wasser Auf einem Dreifuß wird ein kleines Feuer mit Holzspänen entfacht. Die Vorgänge beim Löschen mit Wasser sollen genau beobachtet werden. Beobachtungen: Beim Löschen zischt es und Wasser verdampft in einer Dampfwolke. Theorie: Das kalte Wasser kühlt die brennenden Stoffe so ab, dass der Zündpunkt unterschritten wird. Das Wasser und vor allem der auftretende Wasserdampf unterbinden die Luftzufuhr. Nach diesem Prinzip funktionieren die Sprinkleranlagen in Gebäuden. Ein Glasröhrchen ist mit einer Flüssigkeit wie Alkohol gefüllt, die ab einer bestimmten Temperatur zu sieden beginnt, so dass das Röhrchen platzt. Dadurch wird ein Pfropfen herausgeschleudert, der eine Wasserleitung öffnet. Bei anderen Sprinklern schmilzt ein Metall mit niedrigem Schmelzpunkt, beispielsweise eine Galliumlegierung, so dass eine Feder aufspringt und den Wasserstrahl freigibt.
Aufbau von Feuerlöschern:
Nasslöscher
enthalten Wasser als Löschflüssigkeit. Eine Patrone mit komprimiertem
Kohlenstoffdioxid innerhalb des Feuerlöschers
treibt das Wasser nach dem Schlagen auf einen Schlagstift aus dem Feuerlöscher.
Nicht alle Brände dürfen jedoch mit Wasser gelöscht werden. Bei Bränden von Flüssigkeiten, Gasen oder Metallen verstärkt das Löschen mit Wasser sogar den Brand. Für solche Brände sind spezielle Löschmittel notwendig. Im Kohlensäureschnee-Löscher befindet sich ein Druckbehälter mit flüssigem Kohlenstoffdioxid. Durch das Betätigen des Feuerlöschers entweicht flüssiges Kohlenstoffdioxid, das durch den Druckabfall sofort gefriert, wobei sich Kohlenstoffdioxid-Schnee bildet. Der Schnee besitzt eine Temperatur von −78 °C und kühlt die brennenden Stoffe ab. Außerdem wirkt das Kohlenstoffdioxid erstickend.
b) Löschen mit Schaum
Schaumlöscher
erzeugen beim Löschen einen Schaum, der mit Kohlenstoffdioxid-Bläschen
gefüllt ist. Zur Erzeugung von Kohlenstoffdioxid gibt man in ein hohes
250ml-Becherglas 50 ml Wasser und fügt je einen Teelöffel Natriumhydrogensulfat
und Natriumhydrogencarbonat (Natron) hinzu. Das Sprudeln zeigt die Gasentwicklung
an, ein hineingehaltenes brennendes Streichholz erlischt. Zur Erzeugung
eines Schaums wiederholt man den Versuch und gibt vorher in das Wasser
einen Tropfen Pril.
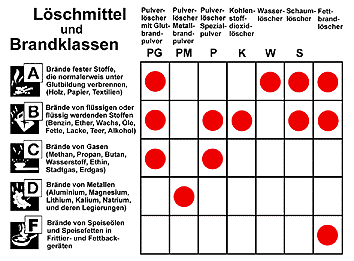
Beobachtungen: Im Becherglas steigt Schaum auf, der zum Löschen geeignet ist. Theorie: Bei der Reaktion von Natron mit Natriumhydrogensulfat entsteht Kohlenstoffdioxid, das die Schaumbläschen füllt. Die Demonstration gelingt auch, wenn man statt Natriumhydrogensulfat Citronensäure oder Weinsäure nimmt. Alternativ dazu können auch Brausetabletten verwendet werden. Schaumlöscher eignen sich zum Löschen für brennbare Flüssigkeiten. Mit ein wenig Geschick kann man sich selbst einen Feuerlöscher aus einer leeren Sprudelflasche und einer aufgesetzten Düse bauen. Die Zutaten dafür sind in jeder Drogerie erhältlich. Sehr verbreitet sind auch spezielle Löschpulver, die mit Stickstoff oder Kohlenstoffdioxid aus dem Feuerlöscher getrieben werden. ABC-Pulver (Glutbrandpulver, PG) eignet sich zum Löschen von Bränden der Brandklassen A, B und C. Es enthält ein Gemisch aus Ammoniumphosphaten und Ammoniumsulfat. Die Ammoniumsalze schmelzen in der Hitze und wirken dann absperrend.
Die neue Brandklasse F ist seit Januar 2005 in die DIN-Norm EN 2 aufgenommen worden. Fette und
Speiseöle gehören eigentlich in die Brandklasse B. Werden Fettbrände
mit Wasser oder aber auch mit Schaumlöschern gelöscht, können
sich Fettexplosionen ereignen. Auch Pulverlöscher und Kohlenstoffdioxidlöscher
sind wenig sinnvoll, da nach Abnahme der Löschmittelkonzentration
das erhitzte Fett wieder von selbst zu brennen beginnt. Löschdecken
sind ebenfalls nicht geeignet, da sie bei einem Fettbrand durchbrennen.
Die nun erhältlichen Fettbrandlöscher
enthalten eine besondere Düse und ein Löschmittel, das sich mit
dem Fett in Schmierseife umwandelt. Einen Fettbrand kann man jedoch auch
durch das Aufsetzen eines Kochtopfdeckels löschen.
Die frühere Brandklasse E – für Brände in elektrischen Anlagen bis 1000 Volt – wurde gestrichen, da die meisten Feuerlöschgeräte bei Niederspannungsanlangen eingesetzt werden können, sofern man genügend Abstand einhält. GBU Deutschland docx pdf SB Schweiz docx pdf Dieser Versuch wird zur Sicherheit am besten im Freien durchgeführt. Auf eine feuerfeste Unterlage wird ein kleines, etwa 3 cm hohes Häufchen mit Magnesiumpulver oder Magnesiumspänen gegeben. Als Unterlage eignet sich ein Holzplättchen auf einer massiven Steinplatte. Das Holz verhindert das Wegspicken des brennenden Magnesiums. Alle Beteiligten, also Lehrkraft und alle Zuschauer müssen eine Schutzbrille und einen geschlossenen Laborkittel tragen! Der Sicherheitsabstand für Zuschauer beträgt mindestens fünf Meter. Die Lehrkraft trägt dicke Schutzhandschuhe aus Leder, die über den Unterarm reichen und ein Gesichtsschild. Dann entzündet sie das Magnesium mit einer Lötlampe und wartet, bis sich der Metallbrand etwas ausgebreitet hat. Nun spritzt sie aus sicherer Entfernung mit einer Spritzflasche Wasser darauf.
Film
Beobachtungen:
Das Magnesium verbrennt nach dem Löschversuch
mit Wasser noch viel heftiger mit sehr grellem Licht. Dabei entstehen so
hohe Temperaturen, dass die Unterlage in manchen Fällen zerbricht
(Bild oben links). Beim Ausbrennen steigen weiße Fäden empor
und man erhält ein weißes Reaktionsprodukt (Bild oben rechts).
Theorie: Beim Löschen von Metallbränden mit Wasser wird das Wasser teilweise zersetzt und es entsteht Wasserstoff. Diese Reaktion erfolgt explosionsartig, wobei der Wasserstoff ein zusätzlich entstandener Brennstoff ist. Variation: Die Demonstration gelingt auch mit einem Magnesiumspitzer, den man mit einer kräftigen Flamme einer Lötlampe an einem Eck entzündet. Zusammenfassung: An der Tafel wird das Gefahrendreieck erarbeitet. Zum Löschen eines Brandes muss mindestens eine der drei Voraussetzungen für einen Brand entfernt werden: 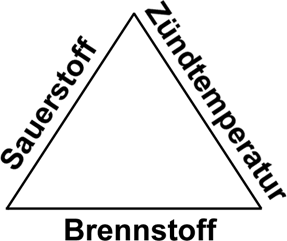
Die Unterbrechung
der Luftzufuhr erreicht man mit Löschdecken, mit Schaumlöschern
oder Pulverlöschern. Das Abkühlen
unter die Zündtemperatur erfolgt mit Wasser, bzw. mit Wasserdampf.
Der Entzug des Brennstoffes wird bei Waldbränden durch das
Ausheben von breiten Gräben oder das Schlagen von Schneisen angewendet. |