Calciumcarbonat kommt in der Natur in drei Modifikationen vor. Der im trigonalen
Kristallsystem kristallisierende
Calcit ist bei den Bergleuten unter dem Namen „Kalkspat“ bekannt. Der
Aragonit hat die gleiche chemische Zusammensetzung wie der Calcit, er kristallisiert aber im orthorhombischen Kristallsystem und besitzt eine höhere Härte und Dichte. Der
Vaterit stellt die dritte natürliche Calciumcarbonat-Modifikation dar, dieses Mineral kristallisiert im hexagonalen Kristallsystem. Das im Chemikalienbedarf erhältliche weiße Pulver löst sich in
Säuren unter Aufschäumen und Entwicklung von
Kohlenstoffdioxid, wobei die entsprechenden
Salze gebildet werden:
CaCO
3 + 2 HCl

CaCl
2 + H
2O + CO
2 In Wasser, in dem Kohlenstoffdioxid gelöst ist, wandelt sich Calciumcarbonat mit der
Kohlensäure zu wasserlöslichem Calciumhydrogencarbonat um. Dabei entsteht ein Gleichgewicht, das auch als Carbonat-Gleichgewicht bezeichnet wird.
CaCO
3 + H
2O + CO
2 
Ca
2+ + 2 HCO
3−
Die entstehenden Calcium-Ionen bewirken die Wasserhärte. Sie bilden mit Seifen schwerlösliche Kalkseifen. In hartem Wasser wird die Waschwirkung von Waschmitteln dadurch erheblich herabgesetzt. Beim Erwärmen oder beim Verdunsten von hartem Wasser kann das Calciumcarbonat wieder zurückgebildet werden. Dieses lagert sich dann in Wasserrohren oder an Heizstäben in Form von Kesselstein ab. Die Entfernung von Kesselstein in Wasserkochern oder Kaffeemaschinen erfolgt mit verdünnten Säuren, beispielsweise mit einer wässrigen Lösung von
Citronensäure oder mit verdünnter
Essigsäure.

Kesselsteinbildung im Wasserrohr.
Beim starken Erhitzen von Calciumcarbonat an der Luft entsteht Calciumoxid (
Branntkalk) und
Kohlenstoffdioxid:
CaCO
3 
CaO + CO
2 ΔHR = +179 kJ/mol Die
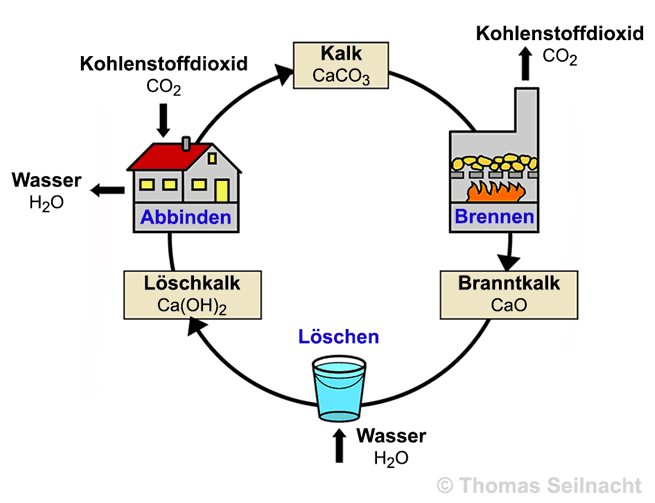
Kalkverarbeitung ist ein Kreislaufprozess:
Calciumcarbonat wird überwiegend aus
natürlichen Vorkommen gewonnen. Meistens erfolgen eine nachträgliche Reinigung und ein Mahlprozess. Der aus Fällungsreaktionen zugängliche Stoff – zum Beispiel bei der Einleitung von Kohlenstoffdioxid in Kalkwasser – wird als synthetisches Calciumcarbonat bezeichnet.
Calciumcarbonat wird in der Bauindustrie häufig benötigt:
Branntkalk oder Mörtel sind bedeutende Grundstoffe. Kalksteine werden zum Häuser- und Straßenbau eingesetzt. Calciumcarbonat ist ein universeller Füllstoff in Kunststoffen, Putz, Farben oder Papier.
Kreide wie Champagnerkreide dient als
Pigment für weiße Anstriche.
Die chemische Industrie benötigt Calciumcarbonat zur Herstellung von
Soda,
Pottasche,
Calciumhydroxid oder
Calciumcarbid. Bei der Rauchgasentschwefelung werden schädliche Gase wie
Schwefeldioxid mit Hilfe von Kalk zu
Gips umgewandelt. Die Stahlindustrie benötigt Kalk als Zuschlag im
Hochofen zum Binden der Gangart und bei der
Stahlerzeugung.
Man findet Calciumcarbonat auch in vielen Haushaltsprodukten: In Zahncremes ist es zum Beispiel als Schleif- und Poliermittel enthalten. Als Zusatz E 170 in Lebensmitteln eignet es sich als Farbpigment, als Trennmittel oder als Säureregulator. Kalk ist auch in diversen
Düngemitteln enthalten, beispielsweise im Kalkdünger oder im Kalkammonsalpeter. Bei der Kalkung oder Kalkdüngung werden die Säuren im Boden neutralisiert. Dies fördert das Wachstum von Pflanzen, die basische Böden bevorzugen.

Kalkdüngung zur Neutralisierung der Säuren im Boden.
Weitere Infos und Medien
Infos zu den
Carbonaten und zur Geschichte der
Kalknutzung
Schülerübung:
Herstellen von Kreide
Mineralienportraits
Calcit und
Aragonit
Serie in 7 Bildern zum
Aufbau eines Kalkofens
Zum Kreislauf der Kalkgewinnung liegt eine Serie in 7 Bildern zur Lösungskontrolle vor. Die Lösungen werden beim Durchklicken im Vollbildmodus nach und nach eingeblendet. Die Serie kann zur Erarbeitung des Arbeitsblattes verwendet werden. Es liegt auch ein Text vor, den man gleichzeitig vorlesen kann.
 Serie starten
Serie starten
Arbeitsblatt
doc docx pdf
Vorlesetext
doc docx pdf
 CaCl2 + H2O + CO2
CaCl2 + H2O + CO2  Ca2+ + 2 HCO3−
Ca2+ + 2 HCO3−  CaO + CO2 ΔHR = +179 kJ/mol
CaO + CO2 ΔHR = +179 kJ/mol