Calciumhydroxid
Ca(OH)2
CAS 1305-62-0
Calciumhydroxid
Calcium hydroxide
74,093 g/mol
1 mg/m3 (TRGS 900)
2,2 g/cm3
+550 °C
100g H2O lösen bei 20 °C 0,160 g (L)
1 mg/m3 (TRGS 900)
2,2 g/cm3
+550 °C
100g H2O lösen bei 20 °C 0,160 g (L)
Lockeres, weißes Pulver

Gefahrenklassen + Kategorie
Schwere Augenschädigung 1
Reizwirkung auf die Haut 2
Spez. Zielorgan-Toxizität einmal. 3
Schwere Augenschädigung 1
Reizwirkung auf die Haut 2
Spez. Zielorgan-Toxizität einmal. 3
Der ätzende Stoff reizt Haut und Schleimhäute und kann schwere Augenschäden verursachen. Beim Herstellen und Arbeiten mit Kalkwasser oder von anderen Mischungen mit Calciumhydroxid müssen Schutzbrille und Schutzhandschuhe getragen werden. Das Verbreiten von Stäuben im Raum muss unbedingt vermieden werden.
In der Natur kommt Calciumhydroxid relativ selten im Mineral Portlandit vor. Reines Calciumhydroxid ist ein lockeres, weißes Pulver, das im Handel in unreiner Form auch als „Löschkalk“ oder „gelöschter Kalk“ erhältlich ist. Beim Erhitzen auf über 550 °C zersetzt es sich unter Bildung von Calciumoxid und Wasser. Calciumhydroxid löst sich nur schlecht in Wasser. Bei steigender Temperatur sinkt die Löslichkeit. Während sich bei 20 °C in einem Liter Wasser rund 1,65 Gramm Calciumhydroxid lösen, sind es bei 100 °C nur noch etwa 0,77 Gramm. Beim Lösen im Wasser werden Hydroxid-Ionen gebildet, die wässrige Lösung wirkt alkalisch:
Eine gesättigte Calciumhydroxid-Lösung in Wasser wird als Kalkwasser bezeichnet, sie erscheint klar und durchsichtig. Der pH-Wert einer gesättigten Lösung liegt etwa bei pH=12. Die frisch zubereitete Lösung dient als Nachweismittel für Kohlenstoffdioxid. Als „Sumpfkalk“ bezeichnet man eine trübe, übersättigte Suspension von Calciumhydroxid in Wasser.

Calciumhydroxid, Kalkwasser und Sumpfkalk.
Ca(OH)2 + H2O  Ca2+ + 2 OH− + H2O
Ca2+ + 2 OH− + H2O
Eine gesättigte Calciumhydroxid-Lösung in Wasser wird als Kalkwasser bezeichnet, sie erscheint klar und durchsichtig. Der pH-Wert einer gesättigten Lösung liegt etwa bei pH=12. Die frisch zubereitete Lösung dient als Nachweismittel für Kohlenstoffdioxid. Als „Sumpfkalk“ bezeichnet man eine trübe, übersättigte Suspension von Calciumhydroxid in Wasser.

Calciumhydroxid, Kalkwasser und Sumpfkalk.
Die Herstellung von Calciumhydroxid erfolgt durch das Einleiten von Calciumoxid oder Branntkalk in Wasser. Dieser Vorgang verläuft unter starker Wärmeentwicklung exotherm und wird als Kalklöschen bezeichnet:
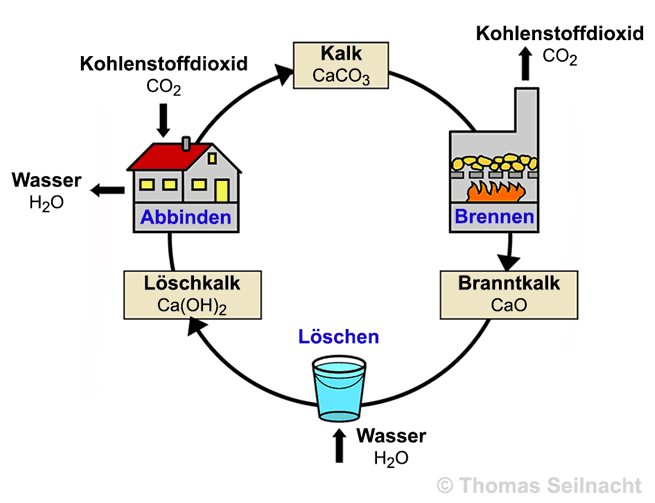
Die Herstellung von Löschkalk hat in der Geschichte der Kalknutzung eine historische Bedeutung. Es ist eines der ersten technischen Verfahren, in dem ein Kreislaufprozess angewendet wurde:
CaO + H2O  Ca(OH)2 ΔHR = −65 kJ/mol
Ca(OH)2 ΔHR = −65 kJ/mol
Die Herstellung von Löschkalk hat in der Geschichte der Kalknutzung eine historische Bedeutung. Es ist eines der ersten technischen Verfahren, in dem ein Kreislaufprozess angewendet wurde:

Bei der Zubereitung von Kalkmörtel werden Calciumhydroxid oder Calciumoxid mit Wasser zu einem wässrigen Brei angerührt und mit der dreifachen Menge Sand versetzt. Mit dem Kohlenstoffdioxid der Luft reagiert der Kalkbrei und bildet wieder kristallinen, harten Kalk. Calciumhydroxid wird alternativ zum Calciumcarbonat bei der Rauchgasentschwefelung eingesetzt. Es dient auch als Bindemittel für wasserlösliche Farben und zum Aufschluss von Casein, ferner als Hilfsmittel bei der Färbung mit Indigo, als Düngemittel, zu Frostschutzanstrichen bei Obstbäumen, in der Medizin zur Behandlung von Verbrennungen und als Gegenmittel bei Schwefelsäure- und Oxalsäurevergiftungen. Die chemische Industrie benötigt es zur Darstellung von Natronlauge aus Natriumcarbonat oder zur Herstellung von Chlorkalk. Kalkwasser ist im chemischen Labor ein wichtiges Nachweismittel für Kohlenstoffdioxid. In Tauchgeräten oder in Narkosegeräten bindet das Calciumhydroxid zusammen mit Natriumhydroxid den ausgeatmeten Kohlenstoffdioxidanteil. Dieser „Atemkalk“ findet auch in der Raumfahrt Anwendung.
Weitere Infos und Medien
Schülerübung: Herstellen einer Caseinfarbe
Infos zur Kalkverarbeitung
Kopiervorlagen: Kalkkreislauf und Kalkverarbeitung
Weitere Infos und Medien
Schülerübung: Herstellen einer Caseinfarbe
Infos zur Kalkverarbeitung
Kopiervorlagen: Kalkkreislauf und Kalkverarbeitung
© Thomas Seilnacht / Benutzerhandbuch / Lizenzbestimmungen / Impressum / Datenschutz / Literaturquellen