Etiketten für PE-Flaschen mit Tropfverschluss (Kleinmengen bis 100ml): docx pdf
Konzentrationsangabe (K)
Konz. bei 20 °C
470 g/l
bedeutet,
dass in einem Liter der konzentrierten Lösung bei 20 °C 470 Gramm des
Stoffes gelöst sind. Erfolgt die Konzentrationsangabe nicht in Gramm, sondern in Mol pro Liter Lösung, dann wird die Stoffmengenkonzentration angegeben.
Löslichkeitsangabe (L)
100 g H2O lösen bei 20 °C
31,66 g
bedeutet,
dass man in 100 Gramm Wasser bei 20 °C 31,66 Gramm des Stoffes auflösen kann.
Massenprozentangabe (M)
bei 25 °C 27,7%
bedeutet,
dass 1000 g der konzentrierten Lösung bei 25 °C 27,7 Massenprozent
des Stoffes enthalten.
Bei den anorganischen
Stoffen wird die Löslichkeitsangabe verwendet, zum Beispiel beim Kaliumnitrat. Wenn nicht anders angegeben, bezieht sich der Wert auf die kristallwasserfreie Substanz. Bei den organischen
Stoffen und bei den Gasen wird die Konzentrationsangabe
bevorzugt. Bei den Herstellungsvorschriften sind die
Abweichungen aufgrund der unterschiedlichen
Dichten mit eingerechnet. Es sind einfache
Vorschriften für den normalen Unterrichtsalltag, ohne dass man
dabei rechnen muss. Sie sind nicht geeignet für eine
Maßanalyse! Benötigt
werden eine Waage mit der Empfindlichkeit 0,01 g, zwei Messkolben 100 ml
und 1000 ml und diverse Messzylinder oder Messpipetten. Die Konzentrationen bei den Säuren und Laugen, sowie bei den hier vorgestellten
Reagenzien werden in Massenprozent angegeben.
0,1 g Alizarinsulfonsäure Natriumsalz in 100 ml Wasser lösen.
44 ml (=40 g) 25%-ige Ammoniaklösung in 60ml Wasser lösen.
Die Lösung setzt bei nicht völlig dichtem Verschluss kontinuierlich Ammoniak frei und verliert allmählich die Konzentration!
4g Ammoniumheptamolybdat Tetrahydrat in 10 ml Wasser lösen.
Nur frisch zubereitete Lösung verwenden!
0,45 g Ammoniumoxalat in 10 ml Wasser lösen.
Nur frisch zubereitete Lösung verwenden!
2,44 g Bariumchlorid in 50 ml Wasser lösen und mit Wasser auf 100 ml auffüllen.
4 g Bariumhydroxid in 100 ml Wasser lösen.
Benedict Reagenz (Nachweis reduzierender Zucker und Aldehyde: gelb-roter Niederschlag)
Benedict Reagenz I: 17 g Natriumcitrat Dihydrat und 10 g Natriumcarbonat wasserfrei in 70ml destilliertem Wasser lösen.
Benedict Reagenz II: 2 g Kupfer(II)-sulfat Pentahydrat in 20 ml Wasser lösen
Beide Lösungen zusammenschütten und filtrieren. Die Lösung ist längere Zeit haltbar.
0,1 g Bromthymolblau in 100 ml Ethanol lösen.
Braune Glasflasche mit Teflon-Verschluss verwenden!
0,1 g Cobaltnitrat in 100 ml Wasser lösen.
Für Schulen ungeeignet! Cobaltnitrat ist krebserzeugend!
1 g Dimethylglyoxim in 100 ml 96%igem Ethanol lösen.
Fehling I: 7 g Kupfersulfat Pentahydrat in 100 ml Wasser lösen
Fehling II: 35 g Kaliumnatriumtartrat und 10 g Natriumhydroxid in 100 ml Wasser lösen.
Reagenz I und II getrennt aufbewahren. Mischung im Verhältnis 1 zu 1 verwenden.
2 g Kaliumiodid in 10 ml Wasser lösen und mit 1 g Iod versetzen, mit Wasser auf 100 ml auffüllen.
Nur stark verdünnte Lösungen in PE-Tropfflasche aufbewahren, sonst braune Glasflasche mit Teflon-Verschluss verwenden.
14,7 g Kaliumdichromat in 80 ml Wasser lösen und mit Wasser auf 100 ml auffüllen.
Für Schulen ungeeignet, Kaliumdichromat ist krebserzeugend!
2,11 g Kaliumhexacyanoferrat(II) Trihydrat in 7 ml Wasser lösen und mit Wasser auf 10ml auffüllen.
Lösung nur relativ frisch zubereitet verwenden! Nicht längere Zeit im Vorrat halten: Gefahr der Blausäure-Bildung!
2 g Calciumhydroxid in 1 Liter Wasser lösen und danach filtrieren (Nutsche).
2 g Lackmus in 100 ml Wasser lösen.
Die Lackmus-Lösung nach Kubel und Tiemann enthält Trichlormethan, das vermutlich krebserzeugend ist. Diese sollte in Schulen nicht verwendet werden! Stattdessen nur frisch zubereitete, wässrige Lösung mit Lackmus einsetzen!
0,2 g Methylorange in 100 ml Wasser lösen.
a) 3 g Natriumhydroxid in 97 ml Wasser lösen.
b) 7 ml (= 9,44 g) 32%-ige Natronlauge in 91 ml Wasser lösen.
Natronlauge ca. 10 %
25ml (= 33,72 g) 32%-ige Natronlauge in 74 ml Wasser lösen.
Zersetzt sich an der Luft zu Natriumcarbonat und Kohlenstoffdioxid!
0,1 g Phenolphthalein in 50 ml Ethanol lösen und mit Wasser oder Ethanol auf 100 ml auffüllen.
Empfehlung für die Schule: nicht selbst zubereiten, fertige Lösung kaufen und auf 0,1 % verdünnen!
5 g Resorcin werden in 95 g Ethanol gelöst.
Reagenz immer frisch zubereiten!
14 ml (= 19,47 g) 65%-ige Salpetersäure in 86 ml Wasser lösen.
Salpetersäure ca. 10 %
12 ml (= 16,69 g) 65%-ige Salpetersäure in 92 ml Wasser lösen.
a) 24 ml (= 28,42 g) 37%-ige Salzsäure in 77 ml Wasser lösen.
b) 29 ml (= 33,35 g) 31%-ige Salzsäure in 70 ml Wasser lösen.
Salzsäure ca. 20 %
a) 50 ml (= 59,22 g) 37%-ige Salzsäure in 50 ml Wasser lösen.
b) 62 ml (= 71,30 g) 31%-ige Salzsäure in 39 ml Wasser lösen.
Achtung: Fuchsin steht im Verdacht, krebserzeugend zu wirken. Der Farbstoff enthält herstellungsbedingt oft auch Parafuchsin, das definitiv krebserzeugend ist. Es darf an Schulen nur Schiffs Reagenz verwendet werden, die weniger als 0,1% Fuchsin enthält.
6 ml (= 11 g) 96%-ige Schwefelsäure vorsichtig in 95ml Wasser lösen
(nicht umgekehrt! Schutzbrille!).
1,7 g Silbernitrat in 50 ml Wasser lösen und mit Wasser auf 100 ml auffüllen.
Nur frisch zubereiten, in kleiner PE-Tropfflasche, schwarz mit Acrylfarbe lackiert, abfüllen! Nicht längere Zeit aufbewahren!
Thymolphthalein-Lösung ca. 0,1 % in Ethanol/Wasser (Indikator, pH 9,3 farblos nach blau)
0,1 g Thymolphthalein in 50 ml Ethanol lösen und mit Wasser oder Ethanol auf 100 ml auffüllen.
27 ml (=29,97 g) 30%-iges Wasserstoffperoxid stabilisiert in 60 ml Wasser lösen.
Wasserstoffperoxid-Lösung ca. 3 %
9ml (=9,99 g) 30%-iges Wasserstoffperoxid stabilisiert in 90 ml Wasser lösen.
Hinweis: Kühl aufbewahren oder frisch zubereiten!
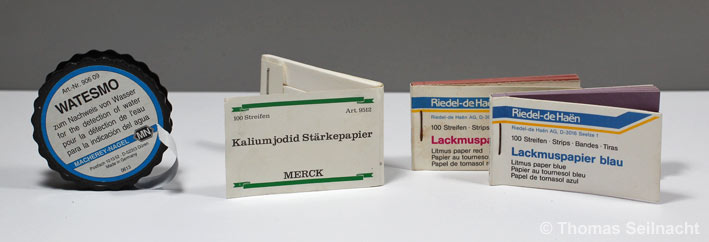
Reagenzpapiere (gut in verschlossenen Behältern
aufbewahren)
Kaliumiodid-Stärkepapier
(Lilafärbung mit Oxidationsmitteln wie Chlor und Ozon)
Lackmuspapier rot und
blau (Nachweis von Säuren und Basen)
Nitrat Teststäbchen
(Nachweis von Nitrat und Nitrit, Lilafärbung)
Universalindikatorpapier
(Bestimmung des pH-Wertes von Säuren und Basen)
Watesmo-Papier zum Wassernachweis (Blaufärbung mit Wasser)