Kaliumiodid
KI
CAS 7681-11-0
Kaliumiodid
Potassium iodide
166,003 g/mol
keine Angaben
3,12 g/cm3
+ 661 °C
100g H2O lösen 144,51 g (L)
keine Angaben
3,12 g/cm3
+ 661 °C
100g H2O lösen 144,51 g (L)
In dunkler Flasche aufbewahren
Weißes, kristallines Pulver

Gefahrenklassen + Kategorie
Spez. Zielorgantoxizität oral 1 (Schilddrüse)
Spez. Zielorgantoxizität oral 1 (Schilddrüse)
Kaliumiodid bildet bei der Zersetzung unter Lichteinfluss Iod. Das Kaliumiodid kann – wie Iod – die Schilddrüse schädigen.
Kaliumiodid ist im Handel als weißes, grobkörniges, kristallines Pulver erhältlich. Das salzig schmeckende Kaliumsalz der Iodwasserstoffsäure bildet klare Kristalle nach dem kubischen System. Es löst sich gut in Wasser unter starker Abkühlung. An der Luft zersetzt sich Kaliumiodid nur ganz langsam unter Einwirkung von UV-Licht. Es bildet sich Iod, was an einer leichten Gelbfärbung erkennbar ist. Kaliumiodid in gut verschlossenen Chemikalienflaschen zersetzt sich aber unter normalen Umständen nicht.

Dieses Kaliumiodid hat sich nicht zersetzt.
Das Halogen Iod bildet in einer wässrigen Kaliumiodid-Lösung ein Iodid-Polymer, das im reinen Zustand farblos ist. Bei Iod-Überschuss erscheint die Lösung gelblich. Iod-Kaliumiodid-Lösung ist die klassische Reagenz zum Stärkenachweis, beispielsweise im Brot oder in anderen Mehlprodukten. Es entsteht dabei ein Polyiodidstärke-Komplex, der an einer blauen oder violetten Färbung erkennbar ist.
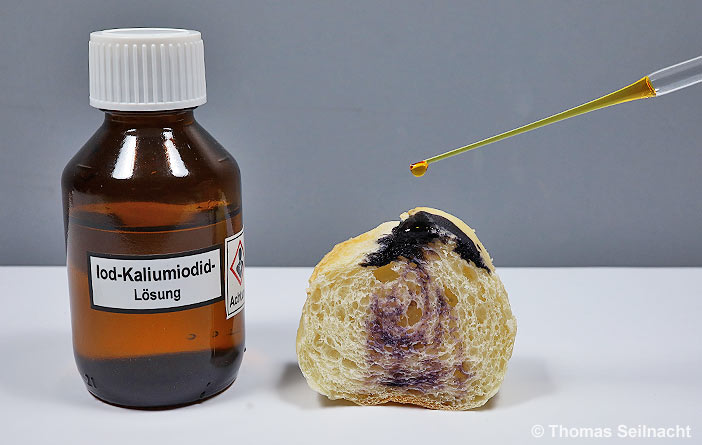
Beim Stärkenachweis bildet sich eine blaue oder violette Färbung.

Dieses Kaliumiodid hat sich nicht zersetzt.
Das Halogen Iod bildet in einer wässrigen Kaliumiodid-Lösung ein Iodid-Polymer, das im reinen Zustand farblos ist. Bei Iod-Überschuss erscheint die Lösung gelblich. Iod-Kaliumiodid-Lösung ist die klassische Reagenz zum Stärkenachweis, beispielsweise im Brot oder in anderen Mehlprodukten. Es entsteht dabei ein Polyiodidstärke-Komplex, der an einer blauen oder violetten Färbung erkennbar ist.

Beim Stärkenachweis bildet sich eine blaue oder violette Färbung.
Die industrielle Herstellung erfolgt durch Reduktion von Kaliumiodat oder durch die Neutralisation von Iodwasserstoffsäure mit Kalilauge. Im Labor kann man Kaliumiodid durch die Reaktion von Eisen(II)-iodid mit Pottasche bei höherer Temperatur gewinnen. Das Eisen(II)-iodid kann durch die Reaktion von Eisenspänen mit Iod erhalten werden:
Das ebenfalls entstehende Eisenhydroxid setzt sich am Boden ab. Die Lösung wird abdekantiert und ein Teil des Wassers aus der Lösung abgedampft. Aus der eingeengten Lösung scheiden sich beim Stehenlassen die Kaliumiodid-Kristalle aus. Eine andere Möglichkeit der Synthese wäre die Reaktion von Kalilauge mit Iod:
Das dabei gleichzeitig entstehende Kaliumiodat kann durch Glühen mit Kohle reduziert werden:
I.) Fe + I2  FeI2 ΔHR = −125,4 kJ/mol
FeI2 ΔHR = −125,4 kJ/mol
II.) H2O + FeI2 + K2CO3 Fe(OH)2 + CO2 + KI
Fe(OH)2 + CO2 + KI
II.) H2O + FeI2 + K2CO3
Das ebenfalls entstehende Eisenhydroxid setzt sich am Boden ab. Die Lösung wird abdekantiert und ein Teil des Wassers aus der Lösung abgedampft. Aus der eingeengten Lösung scheiden sich beim Stehenlassen die Kaliumiodid-Kristalle aus. Eine andere Möglichkeit der Synthese wäre die Reaktion von Kalilauge mit Iod:
6 KOH + 3 I2  5 KI + KIO3 + 3 H2O
5 KI + KIO3 + 3 H2O
Das dabei gleichzeitig entstehende Kaliumiodat kann durch Glühen mit Kohle reduziert werden:
2 KIO3 + 3 C  2 KI + 3 CO2
2 KI + 3 CO2
Kaliumiodid wurde früher zur Iodierung von Speisesalz verwendet, heute verwendet man dafür hauptsächlich Kaliumiodat oder Natriumiodat. Die chemische Industrie benötigt Kaliumiodid zur Herstellung anderer Iodverbindungen wie Silberiodid. In der Medizin und in der Futterindustrie wird es als Iodpräparat verwendet. Im Labor dient Kaliumiodid zur Herstellung von Iod-Kaliumiodid-Stärkenachweispapier oder als vielseitige Reagenz in der analytischen Chemie: In der Maßanalyse wird es zur Bestimmung des Sauerstoffgehalts nach Winkler benötigt. Im Chemieunterricht setzt man man Kaliumiodid als Katalysator beim Versuch „Elefantenzahnpasta“ ein.
Bei Strahlenunfällen wird Kaliumiodid in Form von Tabletten auf behördliche Anordnung verabreicht. In der Schweiz wurden die Iod-Tabletten an die Bevölkerung in 20 Kilometer Umkreis der Atomkraftwerke abgegeben. Das Kaliumiodid reichert sich in den Schilddrüsen an und verhindert damit die Aufnahme von radioaktiven Iod- und Cäsium-Verbindungen.

Kaliumiodid-Tabletten für die Bevölkerung in der Nähe von Atomkraftwerken.
Bei Strahlenunfällen wird Kaliumiodid in Form von Tabletten auf behördliche Anordnung verabreicht. In der Schweiz wurden die Iod-Tabletten an die Bevölkerung in 20 Kilometer Umkreis der Atomkraftwerke abgegeben. Das Kaliumiodid reichert sich in den Schilddrüsen an und verhindert damit die Aufnahme von radioaktiven Iod- und Cäsium-Verbindungen.
Kaliumiodid-Tabletten für die Bevölkerung in der Nähe von Atomkraftwerken.
© Thomas Seilnacht / Benutzerhandbuch / Lizenzbestimmungen / Impressum / Datenschutz / Literaturquellen