Essigsäure
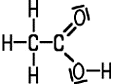
CH3COOH
Essigsäure
Ethansäure
Ethansäure
Acetic acid
Ethanoic acid
Ethanoic acid
Molmasse
AGW
pKs-Wert
Dichte
Schmelzpunkt
Siedepunkt
Wasserlöslichkeit
Explosionsgrenzen
Flammpunkt
Zündpunkt
AGW
pKs-Wert
Dichte
Schmelzpunkt
Siedepunkt
Wasserlöslichkeit
Explosionsgrenzen
Flammpunkt
Zündpunkt
60,052 g/mol
10 ml/m3 (TRGS 900)
+4,756
1,0510 g/cm3
+17 °C
+117,9 °C
vollständig mischbar
4 bis 19,9 Vol.-% (Luft)
+39 °C
+463 °C
10 ml/m3 (TRGS 900)
+4,756
1,0510 g/cm3
+17 °C
+117,9 °C
vollständig mischbar
4 bis 19,9 Vol.-% (Luft)
+39 °C
+463 °C
Klare, farblose Flüssigkeit

Gefahrenklassen + Kategorie
Entzündbare Flüssigkeiten 3
Ätz-/Reizwirkung auf die Haut 1A
(Abstufung bei Verdünnungen)
Entzündbare Flüssigkeiten 3
Ätz-/Reizwirkung auf die Haut 1A
(Abstufung bei Verdünnungen)
HP-Sätze (siehe Hinweis)
H 226, 314
P 210, 260, 280.1–3+7, 303+361+353, 304+340, 305+351+338, 310
Entsorgung Vorbehandlung Säuren/Basen
H 226, 314
P 210, 260, 280.1–3+7, 303+361+353, 304+340, 305+351+338, 310
Entsorgung Vorbehandlung Säuren/Basen
Beim Arbeiten mit der konzentrierten Säure sind Schutzbrille und Schutzhandschuhe erforderlich. Wenn keine geschlossenen Systeme verwendet werden, muss im Abzug gearbeitet werden. Für die verdünnte Säure sind keine Schutzhandschuhe notwendig. Beim Arbeiten mit „Essigessenz" im Haushalt zum Putzen oder Entkalken ist eine Schutzbrille und eine gute Raumlüftung notwendig.
Wirkung auf den menschlichen Körper
Konzentrierte Essigsäure wirkt auf Augen, Haut und Schleimhäute stark ätzend. Die Geruchsschwelle liegt mit 1 bis 5 ppm sehr niedrig, die Schleimhäute werden durch die Dämpfe sofort gereizt. Dies verhindert im Normalfall das Einatmen gefährlicher Konzentrationen. Beim längeren Einatmen von 100 ppm besteht die Gefahr, dass ein Lungenödem entsteht. Es ist zu beachten, dass auch Spritzer des Speiseessigs im Auge schon Augenschäden verursachen können. Sie müssen sofort mit viel Wasser gespült werden.
Essigsäure wird im menschlichen Körper in Stoffwechselprozessen produziert. Sie entsteht auch bei Gärungs- und Fäulnisprozessen.
Chemisch-physikalische Eigenschaften
Konzentrierte, reine Essigsäure ist eine brennbare, hygroskopische Flüssigkeit, die leicht verdampft. Die Dämpfe können mit Luft ein explosionsfähiges Gemisch bilden. Die Carbonsäure ist wie die Ameisensäure aufgrund ihrer Polarität sehr gut wasserlöslich. Sie lässt sich mit polaren und mit unpolaren Lösungsmitteln vermischen, beispielsweise mit Ethylalkohol oder Glycerin, aber auch mit Hexan oder Diethylether. Auch Schwefel und Phosphor werden aufgelöst. Schon unterhalb von 16,64 °C erstarrt die klare Flüssigkeit zu einer eisähnlichen Masse, die als Eisessig bezeichnet wird.
Essigsäure riecht stark stechend nach Essig. Während von der konzentrierten Säure hohe Gesundheitsgefahren ausgehen, wird die stark verdünnte Säure unter der Bezeichnung „Essig“, „Tafelessig“. „Speiseessig“ oder „Haushaltsessig“ als Geschmacksstoff verwendet. Konzentrationen über 15,5 Prozent dürfen nicht mehr als Essig bezeichnet werden. „Essigessenz“ zum Putzen und Entkalken ist in Konzentrationen von 15 bis 25 Prozent erhältlich.
Essigsäure wirkt als Säure, da die Carboxy-Gruppe COOH ein Proton abspalten kann. Kalk, aber auch viele Metalle werden schon von verdünnter Essigsäure unter Bildung der entsprechenden Salze angegriffen. Aluminium ist dagegen widerstandsfähig. Wenn Magnesium mit verdünnter Essigsäure reagiert, entstehen Magnesiumacetat und Wasserstoff:
Die Acetate, oder nach IUPAC die Ethanoate, sind die Salze der Essigsäure. Kupferacetat entsteht nicht spontan unter Wasserstoffbildung, sondern durch eine langsame Oxidation des Kupfers mit Hilfe des Luftsauerstoffs:
Mit Alkoholen entstehen die Ester, die als Riechstoffe eingesetzt werden. Die Ester-Reaktion findet mit Hilfe von Katalysatoren wie Schwefelsäure und unter Wärmeeinfluss statt:
Durch eine Substitutionsreaktion mit Chlor bei 85 °C und unter Zugabe eines Katalysators kann man Chloressigsäure herstellen. Dieser Stoff ist sehr reaktionsfähig, und er ist eine stärkere Säure als die Essigsäure. Er bildet farblose, stechend riechende Kristalle, die bei 61 °C schmelzen. Aufgrund der Reaktionsfähigkeit wird Chloressigsäure zur Herstellung zahlreicher anderer chemischer Verbindungen benötigt, zum Beispiel zum Herstellen von Farbstoffen und Arzneimitteln. Durch eine Umsetzung der Chloressigsäure mit Ammoniak erhält man die Aminosäure Glycin.
Konzentrierte Essigsäure wirkt auf Augen, Haut und Schleimhäute stark ätzend. Die Geruchsschwelle liegt mit 1 bis 5 ppm sehr niedrig, die Schleimhäute werden durch die Dämpfe sofort gereizt. Dies verhindert im Normalfall das Einatmen gefährlicher Konzentrationen. Beim längeren Einatmen von 100 ppm besteht die Gefahr, dass ein Lungenödem entsteht. Es ist zu beachten, dass auch Spritzer des Speiseessigs im Auge schon Augenschäden verursachen können. Sie müssen sofort mit viel Wasser gespült werden.
Essigsäure wird im menschlichen Körper in Stoffwechselprozessen produziert. Sie entsteht auch bei Gärungs- und Fäulnisprozessen.
Chemisch-physikalische Eigenschaften
Konzentrierte, reine Essigsäure ist eine brennbare, hygroskopische Flüssigkeit, die leicht verdampft. Die Dämpfe können mit Luft ein explosionsfähiges Gemisch bilden. Die Carbonsäure ist wie die Ameisensäure aufgrund ihrer Polarität sehr gut wasserlöslich. Sie lässt sich mit polaren und mit unpolaren Lösungsmitteln vermischen, beispielsweise mit Ethylalkohol oder Glycerin, aber auch mit Hexan oder Diethylether. Auch Schwefel und Phosphor werden aufgelöst. Schon unterhalb von 16,64 °C erstarrt die klare Flüssigkeit zu einer eisähnlichen Masse, die als Eisessig bezeichnet wird.
Essigsäure riecht stark stechend nach Essig. Während von der konzentrierten Säure hohe Gesundheitsgefahren ausgehen, wird die stark verdünnte Säure unter der Bezeichnung „Essig“, „Tafelessig“. „Speiseessig“ oder „Haushaltsessig“ als Geschmacksstoff verwendet. Konzentrationen über 15,5 Prozent dürfen nicht mehr als Essig bezeichnet werden. „Essigessenz“ zum Putzen und Entkalken ist in Konzentrationen von 15 bis 25 Prozent erhältlich.
| Konzentration, Massenprozent |
Konzentration, Stoffmenge |
Bezeichnung |
Dichte bei 20 °C |
| 100 % | 17,447 mol/l | „konzentriert, rein“ | 1,048 g/cm3 |
| 25 % | 4,293 mol/l |
„Essigessenz“ | 1,031 g/cm3 |
| 12 % | 2,028 mol/l |
„verdünnt“ | 1,015 g/cm3 |
| 5 % | 0,837 mol/l |
„Essig“ | 1,005 g/cm3 |
Essigsäure wirkt als Säure, da die Carboxy-Gruppe COOH ein Proton abspalten kann. Kalk, aber auch viele Metalle werden schon von verdünnter Essigsäure unter Bildung der entsprechenden Salze angegriffen. Aluminium ist dagegen widerstandsfähig. Wenn Magnesium mit verdünnter Essigsäure reagiert, entstehen Magnesiumacetat und Wasserstoff:
Mg + 2 CH3COOH  Mg(CH3COO)2 + H2
Mg(CH3COO)2 + H2
Die Acetate, oder nach IUPAC die Ethanoate, sind die Salze der Essigsäure. Kupferacetat entsteht nicht spontan unter Wasserstoffbildung, sondern durch eine langsame Oxidation des Kupfers mit Hilfe des Luftsauerstoffs:
2 Cu + 4 CH3COOH + O2  2 Cu(CH3COO)2 + 2 H2O
2 Cu(CH3COO)2 + 2 H2O
Mit Alkoholen entstehen die Ester, die als Riechstoffe eingesetzt werden. Die Ester-Reaktion findet mit Hilfe von Katalysatoren wie Schwefelsäure und unter Wärmeeinfluss statt:
Essigsäure + Methanol  Essigsäuremethylester + Wasser
Essigsäuremethylester + Wasser
Essigsäure + Ethanol Essigsäureethylester + Wasser
Essigsäureethylester + Wasser
Essigsäure + Propanol Essigsäurepropylester + Wasser
Essigsäurepropylester + Wasser
Essigsäure + Ethanol
Essigsäure + Propanol
Durch eine Substitutionsreaktion mit Chlor bei 85 °C und unter Zugabe eines Katalysators kann man Chloressigsäure herstellen. Dieser Stoff ist sehr reaktionsfähig, und er ist eine stärkere Säure als die Essigsäure. Er bildet farblose, stechend riechende Kristalle, die bei 61 °C schmelzen. Aufgrund der Reaktionsfähigkeit wird Chloressigsäure zur Herstellung zahlreicher anderer chemischer Verbindungen benötigt, zum Beispiel zum Herstellen von Farbstoffen und Arzneimitteln. Durch eine Umsetzung der Chloressigsäure mit Ammoniak erhält man die Aminosäure Glycin.
Bleibt Wein länger an der Luft stehen, wird er allmählich sauer. Dieses Verfahren wurde bereits in der Antike angewandt. Dabei oxidiert der Ethanol in einer enzymatischen Oxidation mit Hilfe von Essigbakterien zu Essigsäure. Nach der schon um 1650 von Johann Rudolph Glauber durchgeführten trockenen Holz-Destillation bei 350 °C befinden sich im Destillat etwa 82% Wasser, 7% gelöster Teer und 9% Säuren, die vorwiegend aus Essigsäure bestehen. Heute wird Essigsäure aus Ethin, das in Ethanal umgewandelt wird, hergestellt. Das Ethanal oxidiert dabei mit Hilfe von Katalysatoren zu Essigsäure. Mit einer Carbonylierung kann man ebenfalls Essigsäure herstellen, dabei wird ein CO-Molekül an ein Methanol-Molekül addiert:
H3COH + CO  H3C-COOH
H3C-COOH
Speiseessig ist ein weit verbreiteter Geschmacksstoff und ein Säuerungsmittel. Essigessenz wird für Putz- und Reinigungszwecke verwendet, zum Beispiel zum Entfernen von Kalkablagerungen. Die Essigsäure reagiert mit dem Kalk unter Bildung von Kohlenstoffdioxid. Die Gasentwicklung ist an den Bläschen beim Entkalkungsvorgang zu erkennen:
Aufgrund der keimtötenden Wirkung dient Essigsäure auch als Konservierungsstoff E 260 in Lebensmitteln. Ein bekanntes Beispiel dafür ist das Einlegen von Essiggurken. In der chemischen Industrie ist Essigsäure ein wichtiges Zwischenprodukt zur Herstellung von Kunstfasern, Kunststoffen, Estern, Riechstoffen und Medikamenten. Manche Salze der Essigsäure wie Aluminiumacetat sind Hilfsmittel in der Textil- und Lederindustrie und dienen dort zur Imprägnierung.

Weitere Infos und Medien
Carbonsäuren als Stoffgruppe in der organischen Chemie
Demonstrationen: Ätzwirkung der Stoffe
Arbeiten mit Entkalkern im Haushalt
Schülerübung: Estersynthesen und Essigsäureethylester
Der Säurebegriff im Haushalt und in der Chemie
CaCO3 + 2 CH3COOH  Ca2+ + 2 CH3COO− + CO2 + H2O
Ca2+ + 2 CH3COO− + CO2 + H2O
Aufgrund der keimtötenden Wirkung dient Essigsäure auch als Konservierungsstoff E 260 in Lebensmitteln. Ein bekanntes Beispiel dafür ist das Einlegen von Essiggurken. In der chemischen Industrie ist Essigsäure ein wichtiges Zwischenprodukt zur Herstellung von Kunstfasern, Kunststoffen, Estern, Riechstoffen und Medikamenten. Manche Salze der Essigsäure wie Aluminiumacetat sind Hilfsmittel in der Textil- und Lederindustrie und dienen dort zur Imprägnierung.

Weitere Infos und Medien
Carbonsäuren als Stoffgruppe in der organischen Chemie
Demonstrationen: Ätzwirkung der Stoffe
Arbeiten mit Entkalkern im Haushalt
Schülerübung: Estersynthesen und Essigsäureethylester
Der Säurebegriff im Haushalt und in der Chemie
© Thomas Seilnacht / Benutzerhandbuch / Lizenzbestimmungen / Impressum / Datenschutz / Literaturquellen