Ethan
C2H6
CAS 74-84-0
Ethan
Ethane
Molmasse
AGW
Dichte
Schmelzpunkt
Siedepunkt
Wasserlöslichkeit
Explosionsgrenzen
Flammpunkt
Zündpunkt
AGW
Dichte
Schmelzpunkt
Siedepunkt
Wasserlöslichkeit
Explosionsgrenzen
Flammpunkt
Zündpunkt
30,069 g/mol
keine Angaben
1,3551 g/l (Gas, 0 °C, 1013 hPa)
(Ethan zu Luft = 1,05)
−182,77 °C
−88,6 °C
Konz. bei 25 °C 0,057 g/l
3 bis 12,5 Vol.-% (Luft)
−135 °C
+472 °C
keine Angaben
1,3551 g/l (Gas, 0 °C, 1013 hPa)
(Ethan zu Luft = 1,05)
−182,77 °C
−88,6 °C
Konz. bei 25 °C 0,057 g/l
3 bis 12,5 Vol.-% (Luft)
−135 °C
+472 °C
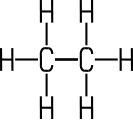
Farbloses, geruchloses Gas

Für Schulen sind im Laborhandel Druckgasdosen mit dem reinen Gas erhältlich. Es gibt Entnahmeventile, die an verschiedenen Flaschen angeschraubt werden können. Ethan kann wie Methan Gasexplosionen auslösen, wenn es sich in größeren Mengen in Räumen verteilt.
Chemisch-physikalische Eigenschaften
Das farb- und geruchlose Gas wirkt schwach betäubend. Ethan löst sich nur ganz wenig in Wasser, in Benzol dafür sehr gut. Das Gas brennt mit schwach leuchtender Flamme. Ethan-Luftgemische sind explosiv, sie verbrennen zu Kohlenstoffdioxid und Wasser.

Ethan kommt im Erdgas, im Erdöl und im Sumpfgas vor. Letzteres entsteht bei der anaeroben Gärung von organischen Stoffen. Auch auf den Planeten Jupiter, Saturn und Neptun, sowie auf einigen Monden der Planeten und Kometen ist Ethan nachweisbar.
Das farb- und geruchlose Gas wirkt schwach betäubend. Ethan löst sich nur ganz wenig in Wasser, in Benzol dafür sehr gut. Das Gas brennt mit schwach leuchtender Flamme. Ethan-Luftgemische sind explosiv, sie verbrennen zu Kohlenstoffdioxid und Wasser.
Ethan kommt im Erdgas, im Erdöl und im Sumpfgas vor. Letzteres entsteht bei der anaeroben Gärung von organischen Stoffen. Auch auf den Planeten Jupiter, Saturn und Neptun, sowie auf einigen Monden der Planeten und Kometen ist Ethan nachweisbar.
Im Labor kann man Ethan durch eine Elektrolyse einer konzentrierten Natriumacetat-Lösung gewinnen, wobei an der Kathode Wasserstoff und an der Anode Ethan und Kohlenstoffdioxid entsteht. In der Industrie gewinnt man das Gas bei der Erdöldestillation aus Erdgas oder bei Erdöl- und Kohlehydrierungen.
Ethan ist als Heizgas im Erdgas enthalten. In der chemischen Industrie dient es zur Gewinnung von Ethen. Beim thermischen Cracken von Ethan oder Kohlenwasserstoffgemischen entstehen oberhalb von 1000 °C Ethen und Wasserstoff:
Weitere Infos und Medien
Kohlenwasserstoffe als Stoffgruppe in der organischen Chemie
H3C-CH3  H2C=CH2 + H2
H2C=CH2 + H2
Weitere Infos und Medien
Kohlenwasserstoffe als Stoffgruppe in der organischen Chemie
© Thomas Seilnacht / Benutzerhandbuch / Lizenzbestimmungen / Impressum / Datenschutz / Literaturquellen