Kohlenstoffmonooxid
CO
Kohlenstoffmonooxid
Kohlenmonoxid
Kohlenmonoxid
Carbon monoxide
Molmasse
AGW
Dichte
Schmelzpunkt
Siedepunkt
Wasserlöslichkeit
Explosionsgrenzen
Flammpunkt
Zündpunkt
AGW
Dichte
Schmelzpunkt
Siedepunkt
Wasserlöslichkeit
Explosionsgrenzen
Flammpunkt
Zündpunkt
28,010 g/mol
20 ml/m3 oder 23 mg/m3 (TRGS 900)
1,2506 g/l (Gas, 0° C, 1013 hPa)
(CO zu Luft = 0,97)
−205,1 °C
−191,51 °C
Konz. bei 20 °C 0,030 g/l
12,5 bis 74 Vol.-% (Luft)
−191 °C
+ 609 °C
20 ml/m3 oder 23 mg/m3 (TRGS 900)
1,2506 g/l (Gas, 0° C, 1013 hPa)
(CO zu Luft = 0,97)
−205,1 °C
−191,51 °C
Konz. bei 20 °C 0,030 g/l
12,5 bis 74 Vol.-% (Luft)
−191 °C
+ 609 °C
Farb- und geruchloses Gas




Gefahrenklassen + Kategorie
Entzündbare Gase 1
Gase unter Druck, verdicht. Gas
Akute Toxizität inhalativ 3
Reproduktionstoxizität (D) 1A
Spez. Zielorgantox. (w.) 1
Entzündbare Gase 1
Gase unter Druck, verdicht. Gas
Akute Toxizität inhalativ 3
Reproduktionstoxizität (D) 1A
Spez. Zielorgantox. (w.) 1
Mutterschutz beachten! Kohlenstoffmonooxid ist ein reprotoxischer Stoff der Kategorie 1A. In Deutschland besteht ein Tätigkeitsverbot für werdende und stillende Mütter, sowie für Schülerinnen und Schüler. Die Gefahren und Vorsichtsmaßnahmen beim Umgang mit Kohlenstoffmonooxid sind auch im Haushalt zu beachten.
Wirkung auf den menschlichen Körper
Kohlenstoffmonooxid ist ein giftiges und heimtückisches Gas, da es keinen Geruch besitzt und auch keine Atemnot auslöst. Eine akute Vergiftung äußert sich zuerst in Euphorie und Gleichgültigkeit, dann folgen Kopfschmerzen, Benommenheit, Bewusstlosigkeit und Tod. Die Giftwirkung des Gases beruht auf einer chemischen Reaktion mit dem roten Blutfarbstoff Hämoglobin, so dass der Sauerstofftransport im Blut gestört wird. Eine Konzentration von 0,1 Volumenprozent in der Atemluft wirkt nach längerem Einatmen tödlich. Selbst das Einatmen von geringen Dosen (0,01%) führt langfristig zu chronischen Erkrankungen an Herz und Nerven. Diese Gefahr besteht vor allem in dicht besiedelten Gebieten mit vielen Ampeln, da Autos im Leerlauf eine hohe Dosis Kohlenstoffmonooxid an die Luft abgeben.
Chemisch-physikalische Eigenschaften
Kohlenstoffmonooxid ist ein farb- und geruchloses Gas. Es löst sich wenig in Wasser, in Ethylalkohol und in Chloroform ist es besser löslich. Das Gas ist etwas leichter als Luft. Oberhalb von 700 °C verbrennt es mit bläulicher Flamme zu Kohlenstoffdioxid:
Die Reaktion mit reinem Sauerstoff läuft sehr heftig ab, es bilden sich dabei Knallgasgemische, die kräftig explodieren. Aber auch bei Mischung mit Luft entstehen explosionsgefährliche Gemische. Im Gegensatz zum Kohlenstoffdioxid ist es viel reaktionsfähiger. Es reagiert unter Hitze mit Nichtmetallen wie Wasserstoff, Schwefel und Chlor und mit Metallen, wobei sich giftige Metallcarbonyle bilden. Lässt man das Gas bei etwa 200 °C unter Druck über Eisenpulver strömen, bildet sich Eisencarbonyl, eine giftige, gelbe Flüssigkeit mit der Formel Fe(CO)5. Gemische mit Wasserstoff werden als Synthesegas bezeichnet. Sie dienen zur Herstellung von Methanol oder werden zur Herstellung von Methan oder anderen Kohlenwasserstoffen bei der Fischer-Tropsch-Synthese verwendet:
Kohlenstoffmonooxid ist ein giftiges und heimtückisches Gas, da es keinen Geruch besitzt und auch keine Atemnot auslöst. Eine akute Vergiftung äußert sich zuerst in Euphorie und Gleichgültigkeit, dann folgen Kopfschmerzen, Benommenheit, Bewusstlosigkeit und Tod. Die Giftwirkung des Gases beruht auf einer chemischen Reaktion mit dem roten Blutfarbstoff Hämoglobin, so dass der Sauerstofftransport im Blut gestört wird. Eine Konzentration von 0,1 Volumenprozent in der Atemluft wirkt nach längerem Einatmen tödlich. Selbst das Einatmen von geringen Dosen (0,01%) führt langfristig zu chronischen Erkrankungen an Herz und Nerven. Diese Gefahr besteht vor allem in dicht besiedelten Gebieten mit vielen Ampeln, da Autos im Leerlauf eine hohe Dosis Kohlenstoffmonooxid an die Luft abgeben.
Chemisch-physikalische Eigenschaften
Kohlenstoffmonooxid ist ein farb- und geruchloses Gas. Es löst sich wenig in Wasser, in Ethylalkohol und in Chloroform ist es besser löslich. Das Gas ist etwas leichter als Luft. Oberhalb von 700 °C verbrennt es mit bläulicher Flamme zu Kohlenstoffdioxid:
CO + 1/2 O2  CO2 ΔHR = −282 kJ/mol
CO2 ΔHR = −282 kJ/mol
Die Reaktion mit reinem Sauerstoff läuft sehr heftig ab, es bilden sich dabei Knallgasgemische, die kräftig explodieren. Aber auch bei Mischung mit Luft entstehen explosionsgefährliche Gemische. Im Gegensatz zum Kohlenstoffdioxid ist es viel reaktionsfähiger. Es reagiert unter Hitze mit Nichtmetallen wie Wasserstoff, Schwefel und Chlor und mit Metallen, wobei sich giftige Metallcarbonyle bilden. Lässt man das Gas bei etwa 200 °C unter Druck über Eisenpulver strömen, bildet sich Eisencarbonyl, eine giftige, gelbe Flüssigkeit mit der Formel Fe(CO)5. Gemische mit Wasserstoff werden als Synthesegas bezeichnet. Sie dienen zur Herstellung von Methanol oder werden zur Herstellung von Methan oder anderen Kohlenwasserstoffen bei der Fischer-Tropsch-Synthese verwendet:
CO + 3 H2  CH4 + H2O ΔHR = −206 kJ/mol
CH4 + H2O ΔHR = −206 kJ/mol
Kohlenstoffmonooxid entsteht in nicht wirtschaftlich verwertbaren Mengen bei bakteriologischen Abbauprozessen im Boden und im Meer. Im Labor erhält man Kohlenstoffmonooxid durch das Erhitzen eines Gemisches aus reiner Ameisensäure mit konzentrierter Schwefelsäure:
Diese Reaktion darf nur im kleinen Maßstab im Abzug durchgeführt werden (Schutzbrille!). In der Düse befindet sich eine Rückschlagsicherung. Das ausströmende Gas wird erst nach einer Weile entzündet. Dadurch wird verhindert, dass das anfänglich in der Apparatur vorhandene Knallgasgemisch zündet. In der Industrie kommen verschiedene Herstellungsverfahren zur Anwendung. Bei der Synthesegaserzeugung wird Methan bei etwa 900 °C und bei Anwesenheit eines Katalysators in Gegenwart von Wasser katalytisch gespalten:
Man erhält ein Gemisch aus Kohlenstoffmonooxid und Wasserstoff. Bei der Verbrennung von Koks unter Luftabschluss (Totalvergasung) mit hohen Temperaturen erhält man ebenfalls Synthesegas:
Blässt man Luft über glühenden Koks, verbrennt dieser mit dem Sauerstoff. Dabei spielen sich folgende Vorgänge ab:
Damit sich das Gleichgewicht in der zweiten Reaktionsgleichung möglichst weit nach rechts verschiebt, muss die Temperatur nach dem Boudouard-Gleichgewicht möglichst hoch liegen.
HCOOH  CO + H2O
CO + H2O
Diese Reaktion darf nur im kleinen Maßstab im Abzug durchgeführt werden (Schutzbrille!). In der Düse befindet sich eine Rückschlagsicherung. Das ausströmende Gas wird erst nach einer Weile entzündet. Dadurch wird verhindert, dass das anfänglich in der Apparatur vorhandene Knallgasgemisch zündet. In der Industrie kommen verschiedene Herstellungsverfahren zur Anwendung. Bei der Synthesegaserzeugung wird Methan bei etwa 900 °C und bei Anwesenheit eines Katalysators in Gegenwart von Wasser katalytisch gespalten:
CH4 + H2O 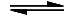 CO + 3 H2 ΔHR = +206 kJ/mol
CO + 3 H2 ΔHR = +206 kJ/mol
Man erhält ein Gemisch aus Kohlenstoffmonooxid und Wasserstoff. Bei der Verbrennung von Koks unter Luftabschluss (Totalvergasung) mit hohen Temperaturen erhält man ebenfalls Synthesegas:
C (glühend) + H2O 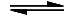 CO + H2 ΔHR = +131 kJ/mol
CO + H2 ΔHR = +131 kJ/mol
Blässt man Luft über glühenden Koks, verbrennt dieser mit dem Sauerstoff. Dabei spielen sich folgende Vorgänge ab:
I.) C + O2 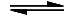 CO2
CO2
II.) CO2 + C 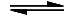 2 CO
2 CO
Damit sich das Gleichgewicht in der zweiten Reaktionsgleichung möglichst weit nach rechts verschiebt, muss die Temperatur nach dem Boudouard-Gleichgewicht möglichst hoch liegen.
Kohlenstoffmonooxid dient zur Herstellung von Methan und anderen Kohlenwasserstoffen, von Methanol, Ameisensäure, Essigsäure und anderen Carbonsäuren, von Estern, Phosgen und einer Vielzahl anderer organischer Verbindungen. Im Hochofen wird es als Reduktionsmittel für das Eisenerz gebraucht.
Tragödie von Arnstein (bei Würzburg)
Am 28. Januar 2017 starben zwei Jugendliche und vier junge Erwachsene bei einer Feier in einer Gartenlaube an einer Kohlenstoffmonooxid-Vergiftung. Eine der jungen Frauen hatte den 18. Geburtstag gefeiert. Der Vater der beiden Jugendlichen fand die leblosen Körper am Morgen in dem Gartenhäuschen. Von diesem Fall wurde in der Presse ausführlich berichtet. Weniger bekannt ist, dass jedes Jahr etwa 1000 Menschen alleine in Deutschland an einer solchen Vergiftung sterben und sich mehr als 3000 vergiften. Besonders gefährdet sind auch Haustiere: Katzen können schon durch geringste Konzentrationen eine tödliche Nierenentzündung erleiden. Die Regeln beim Umgang mit Brennern, Kaminen und Öfen im Haushalt sind unbedingt zu verinnerlichen.
Weitere Infos und Medien
Aufbau des Hochofens
Experimente zum Hochofen
Gefahren beim Umgang mit Kohlenstoffmonooxid
Tragödie von Arnstein (bei Würzburg)
Am 28. Januar 2017 starben zwei Jugendliche und vier junge Erwachsene bei einer Feier in einer Gartenlaube an einer Kohlenstoffmonooxid-Vergiftung. Eine der jungen Frauen hatte den 18. Geburtstag gefeiert. Der Vater der beiden Jugendlichen fand die leblosen Körper am Morgen in dem Gartenhäuschen. Von diesem Fall wurde in der Presse ausführlich berichtet. Weniger bekannt ist, dass jedes Jahr etwa 1000 Menschen alleine in Deutschland an einer solchen Vergiftung sterben und sich mehr als 3000 vergiften. Besonders gefährdet sind auch Haustiere: Katzen können schon durch geringste Konzentrationen eine tödliche Nierenentzündung erleiden. Die Regeln beim Umgang mit Brennern, Kaminen und Öfen im Haushalt sind unbedingt zu verinnerlichen.
Weitere Infos und Medien
Aufbau des Hochofens
Experimente zum Hochofen
Gefahren beim Umgang mit Kohlenstoffmonooxid
© Thomas Seilnacht / Benutzerhandbuch / Lizenzbestimmungen / Impressum / Datenschutz / Literaturquellen