Gasflaschen mit Chlorwasserstoff an Schulen nicht aufbewahren! Werdende oder stillende Mütter dürfen mit Chlorwasserstoff nicht arbeiten. Zur Demonstration der Eigenschaften kann das Gas durch Erhitzen aus rauchender Salzsäure ausgetrieben werden. Dafür ist ein Abzug notwendig. Schutzbrille und Schutzhandschuhe müssen angezogen werden. Der Springbrunnenversuch ist im Fachraum als Demoversuch bei guter Lüftung möglich, da mit einer geschlossenen Apparatur gearbeitet wird. Da ein kurzzeitiges Vakuum auftritt, müssen auch die Zuschauer Schutzbrillen tragen, oder es wird eine Schutzscheibe eingesetzt.
Gefährdungsbeurteilung Deutschland (auch EU)
GBU Arbeiten mit Chlorwasserstoff: Springbrunnenversuch
Sicherheitsbetrachtung Schweiz
SB Arbeiten mit Chlorwasserstoff: Springbrunnenversuch
Chlorwasserstoff
HCl
CAS 7647-01-0
Chlorwasserstoff
Hydrogen chloride
36,461 g/mol
2 ml/m³ oder 3 mg/m³ (TRGS 900)
1,6423 g/l (Gas, 0 °C, 1013 hPa)
(HCl zu Luft = 1,27)
−114,17 °C
−85 °C
Konz. bei 20 °C 720 g/l
2 ml/m³ oder 3 mg/m³ (TRGS 900)
1,6423 g/l (Gas, 0 °C, 1013 hPa)
(HCl zu Luft = 1,27)
−114,17 °C
−85 °C
Konz. bei 20 °C 720 g/l
Farbloses, stechend riechendes Gas


Gefahrenklassen + Kategorie
Gase unter Druck, verdicht. Gas
Akute Toxizität inhalativ 3
Ätz/Reizwirkung auf die Haut 1A
Gase unter Druck, verdicht. Gas
Akute Toxizität inhalativ 3
Ätz/Reizwirkung auf die Haut 1A
HP-Sätze (siehe Hinweis)
H 280, 314, 331
P 260, 280,1-3+7, 304+340, 303+361+353, 305+351+338, 315, 403, 405
Entsorgung besondere Hinweise
H 280, 314, 331
P 260, 280,1-3+7, 304+340, 303+361+353, 305+351+338, 315, 403, 405
Entsorgung besondere Hinweise
Wirkung auf den menschlichen Körper
Die Dämpfe reizen Haut, Augen, Schleimhäute und die Atmungsorgane. Chlorwasserstoff zerstört Schleimhautzellen, beim Eindringen in den Kehlkopf besteht die Gefahr der Ausbildung eines tödlichen Kehlkopfödems. Dabei schwillt das Gewebe durch das Eindringen von Wasser an. Bei hohen Konzentrationen dringt das Gas in die tieferen Luftwege und schädigt die Bronchien und die Lungenbläschen. Auch dort kann ein Lungenödem zum Tode führen. Eine Schädigung der Lungenkapillaren kann als Nachwirkung auch Schocksymptome oder Infarkte verursachen. Ob eine gefährliche Reaktion im Kehlkopf oder an den unteren Atemwegsorganen auftritt, hängt von der Gesamtmenge des eingeatmeten Gases ab, eine kurze Reizwirkung muss nicht zwangsläufig zu gefährlichen Reaktionen führen. Das Gas löst sich sofort in der Flüssigkeit der Mundschleimhaut, die entstehende Säure greift auch die Zähne an. Auch reagieren verschiedene Personen unterschiedlich. Beim häufigen Einatmen geringer Konzentrationen besteht die Gefahr einer chronischen Bronchitis.
Chemisch-physikalische Eigenschaften
Chlorwasserstoff ist ein farbloses, stechend riechendes Gas, das nicht brennbar ist. Das Gas ist in Wasser außerordentlich gut löslich, bei Zimmertemperatur (20 °C) lösen sich 442 Liter Gas in einem Liter Wasser. Die Lösung des Gases in Wasser nennt man Salzsäure. Beim Springbrunnenversuch wird ein mit Chlorwasserstoff gefüllter Rundkolben, der mit einer Düse versehen ist, in einen Behälter mit Wasser gehalten:
Im trockenen Zustand ist Chlorwasserstoff selbst bei hohen Temperaturen stabil. An feuchter Luft bildet sich ein feiner Nebel aus Salzsäuretröpfchen. Unter Druck verflüssigter, wasserfreier Chlorwasserstoff leitet elektrischen Strom ähnlich gut wie die Salzsäure. Chlorwasserstoff dient in der organischen Chemie als Grundstoff für zahlreiche Synthesen. Unter Druck lagert er sich bei 200 °C in Gegenwart von Quecksilber auf Aktivkohle an Acetylen an:
Polyvinylchlorid (PVC), als Polymerisationsprodukt des Vinylchlorids, ist ein bedeutender Kunststoff. Allerdings wird die beschriebene Reaktion heute kaum noch zur Herstellung von PVC verwendet. Bei der Oxychlorierung werden Chlor-Atome in eine organische Verbindung eingebaut. In Gegenwart von Kupfer(II)-chlorid lässt sich Ethylen bei 180 °C mit Hilfe von Chlorwasserstoff zunächst zu 1,2-Dichlorethan umwandeln. Danach kann man durch Erhitzen wieder Chlorwasserstoff abspalten, so dass ebenfalls Vinylchlorid entsteht. Dieses technische Verfahren ist heute eher gebräuchlich. Auch Alkane lassen sich mit der Oxychlorierung chlorieren. Bei etwa 450° Celsius erhält man in Gegenwart von Kupfersalzen aus Methan den Halogenkohlenwasserstoff Chlormethan (Methylchlorid):
Bei der Chlormethylierung wird die Atomgruppe -CH2Cl in eine organische Verbindung eingeführt. Hierzu wird eine aromatische Verbindung wie Benzol mit Formaldehyd versetzt. Leitet man danach Chlorwasserstoff in Gegenwart von Zinkchlorid oder Aluminiumchlorid ein, erhält man Benzylchlorid:
Bei dieser Reaktion entsteht aber als Nebenprodukt der äußerst gefährliche Bis(chlormethyl)ether (BCME oder 1,1-Dichlordimethylether):
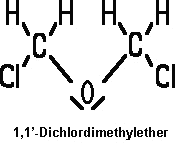 BCME gehört zu den am stärksten bekannten, krebserzeugenden Stoffen. Außerdem wirkt er beim Einatmen sehr toxisch. Sobald Chlorwasserstoff und Formaldehyd zusammenkommen, besteht die Gefahr einer Bildung von BCME. Er zerfällt bei Wasserzugabe wieder relativ leicht zu Chlorwasserstoff und Formaldehyd. Auch an trockener Luft zerfällt er und kann dabei explosive Peroxide bilden. In feuchter Luft hält sich BCME aber einige Zeit stabil.
BCME gehört zu den am stärksten bekannten, krebserzeugenden Stoffen. Außerdem wirkt er beim Einatmen sehr toxisch. Sobald Chlorwasserstoff und Formaldehyd zusammenkommen, besteht die Gefahr einer Bildung von BCME. Er zerfällt bei Wasserzugabe wieder relativ leicht zu Chlorwasserstoff und Formaldehyd. Auch an trockener Luft zerfällt er und kann dabei explosive Peroxide bilden. In feuchter Luft hält sich BCME aber einige Zeit stabil.
Die Dämpfe reizen Haut, Augen, Schleimhäute und die Atmungsorgane. Chlorwasserstoff zerstört Schleimhautzellen, beim Eindringen in den Kehlkopf besteht die Gefahr der Ausbildung eines tödlichen Kehlkopfödems. Dabei schwillt das Gewebe durch das Eindringen von Wasser an. Bei hohen Konzentrationen dringt das Gas in die tieferen Luftwege und schädigt die Bronchien und die Lungenbläschen. Auch dort kann ein Lungenödem zum Tode führen. Eine Schädigung der Lungenkapillaren kann als Nachwirkung auch Schocksymptome oder Infarkte verursachen. Ob eine gefährliche Reaktion im Kehlkopf oder an den unteren Atemwegsorganen auftritt, hängt von der Gesamtmenge des eingeatmeten Gases ab, eine kurze Reizwirkung muss nicht zwangsläufig zu gefährlichen Reaktionen führen. Das Gas löst sich sofort in der Flüssigkeit der Mundschleimhaut, die entstehende Säure greift auch die Zähne an. Auch reagieren verschiedene Personen unterschiedlich. Beim häufigen Einatmen geringer Konzentrationen besteht die Gefahr einer chronischen Bronchitis.
Chemisch-physikalische Eigenschaften
Chlorwasserstoff ist ein farbloses, stechend riechendes Gas, das nicht brennbar ist. Das Gas ist in Wasser außerordentlich gut löslich, bei Zimmertemperatur (20 °C) lösen sich 442 Liter Gas in einem Liter Wasser. Die Lösung des Gases in Wasser nennt man Salzsäure. Beim Springbrunnenversuch wird ein mit Chlorwasserstoff gefüllter Rundkolben, der mit einer Düse versehen ist, in einen Behälter mit Wasser gehalten:
Im trockenen Zustand ist Chlorwasserstoff selbst bei hohen Temperaturen stabil. An feuchter Luft bildet sich ein feiner Nebel aus Salzsäuretröpfchen. Unter Druck verflüssigter, wasserfreier Chlorwasserstoff leitet elektrischen Strom ähnlich gut wie die Salzsäure. Chlorwasserstoff dient in der organischen Chemie als Grundstoff für zahlreiche Synthesen. Unter Druck lagert er sich bei 200 °C in Gegenwart von Quecksilber auf Aktivkohle an Acetylen an:
C2H2 + HCl  H2C=CHCl
H2C=CHCl
Acetylen + Chlorwasserstoff Vinylchlorid
Vinylchlorid
Acetylen + Chlorwasserstoff
Polyvinylchlorid (PVC), als Polymerisationsprodukt des Vinylchlorids, ist ein bedeutender Kunststoff. Allerdings wird die beschriebene Reaktion heute kaum noch zur Herstellung von PVC verwendet. Bei der Oxychlorierung werden Chlor-Atome in eine organische Verbindung eingebaut. In Gegenwart von Kupfer(II)-chlorid lässt sich Ethylen bei 180 °C mit Hilfe von Chlorwasserstoff zunächst zu 1,2-Dichlorethan umwandeln. Danach kann man durch Erhitzen wieder Chlorwasserstoff abspalten, so dass ebenfalls Vinylchlorid entsteht. Dieses technische Verfahren ist heute eher gebräuchlich. Auch Alkane lassen sich mit der Oxychlorierung chlorieren. Bei etwa 450° Celsius erhält man in Gegenwart von Kupfersalzen aus Methan den Halogenkohlenwasserstoff Chlormethan (Methylchlorid):
2 CH4 + 2 HCl + O2  2 CH3Cl + 2 H2O
2 CH3Cl + 2 H2O
Methan + Chlorwasserstoff + Sauerstoff Chlormethan + Wasser
Chlormethan + Wasser
Methan + Chlorwasserstoff + Sauerstoff
Bei der Chlormethylierung wird die Atomgruppe -CH2Cl in eine organische Verbindung eingeführt. Hierzu wird eine aromatische Verbindung wie Benzol mit Formaldehyd versetzt. Leitet man danach Chlorwasserstoff in Gegenwart von Zinkchlorid oder Aluminiumchlorid ein, erhält man Benzylchlorid:
C6H6 + HCOH + HCl  C6H5-CH2Cl + H2O
C6H5-CH2Cl + H2O
Benzol + Formaldeyhd + Chlorwasserstoff Benzylchlorid + Wasser
Benzylchlorid + Wasser
Benzol + Formaldeyhd + Chlorwasserstoff
Bei dieser Reaktion entsteht aber als Nebenprodukt der äußerst gefährliche Bis(chlormethyl)ether (BCME oder 1,1-Dichlordimethylether):

Im Labor erhält man Chlorwasserstoff durch die Reaktion von Chlor mit Wasserstoff. Diese Reaktion kann, vor allem unter Lichteinwirkung, explosionsartig erfolgen:
Eine andere Möglichkeit ist die Umsetzung von Natriumchlorid (Kochsalz) und Schwefelsäure:
Zur großtechnischen Gewinnung von Chlorwasserstoff: siehe unter Salzsäure.
H2 + Cl2  2 HCl ΔHR = −184 kJ/mol
2 HCl ΔHR = −184 kJ/mol
Eine andere Möglichkeit ist die Umsetzung von Natriumchlorid (Kochsalz) und Schwefelsäure:
NaCl + H2SO4  HCl + NaHSO4
HCl + NaHSO4
Zur großtechnischen Gewinnung von Chlorwasserstoff: siehe unter Salzsäure.
Chlorwasserstoff dient in der chemischen Industrie zur Herstellung von Salzsäure und Chloriden, zur Synthese von organischen Verbindungen (Chlorsulfonsäure oder PVC) oder zur Isomerisierung von Kohlenwasserstoffen. Neuerdings wird zunehmend verflüssigter, wasserfreier Chlorwasserstoff statt Salzsäure verwendet, da er Rohrleitungen nicht angreift.
Weitere Infos und Medien
Filme: Springbrunnenversuch
Digitale Folien: Säuren, Laugen, Salze
Buch individuell erstellen: Basis-Text Chlorwasserstoff und Salzsäure


> Inhaltsverzeichnis
Weitere Infos und Medien
Filme: Springbrunnenversuch
Digitale Folien: Säuren, Laugen, Salze
Buch individuell erstellen: Basis-Text Chlorwasserstoff und Salzsäure


> Inhaltsverzeichnis
© Thomas Seilnacht / Benutzerhandbuch / Lizenzbestimmungen / Impressum / Datenschutz / Literaturquellen