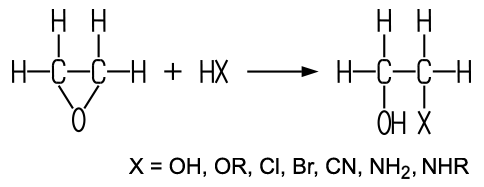|
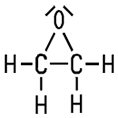 Farbloses Gas mit süßlichem Geruch |
Molmasse 44,052 g/mol AGW 1 ml/m3 oder 1,8 mg/m3 (EU) Dichte 1,965 g/l (Gas, 0 °C, 1013 hPa) (Ethylenoxid zu Luft = 1,52) Schmelzpunkt −112,5 °C Siedepunkt +10,6 °C Wasserlöslichkeit gut löslich Explosionsgr. 3 bis 100 Vol.-% (Luft) Flammpunkt −20 °C Zündpunkt +429 °C |
| Piktogramme GHS 02 GHS 04 GHS 06 GHS 08 Gefahr |
Gefahrenklassen
+ Kategorie Entzündbare Gase 1 Gase unter Druck, verdicht. Gas Akute Toxizität oral und inhalativ 3 Ätz/Reizwirkung auf die Haut 1 Schwere Augenschäd./-reizung 1 Keimzellenmutagenität 1B Karzinogenität 1B Reproduktionstoxizität 1B Spez. Zielorgantoxizität (Lunge 1, Atemwege + Nervensystem 3) |
HP-Sätze (siehe Hinweis) H 220, 280, 301, 314, 331, 335, 336, 340, 350, 360fd, 372 P 210, 261, 280.1-3+6-7, 377, 304+340, 308+313, 410+403 Entsorgung besondere Hinweise |
| Dt. Bezeichnung Synonyme (deutsch) |
Engl. Bezeichnung Synonyme (engl.) |
|
| CAS 75-21-8 | Ethylenoxid Oxiran |
Ethylene oxide Oxirane |
| Eigenschaften Das farblose Gas löst
sich gut in Wasser, geht aber dann langsam in Ethylenglykol über. Mit Salzsäure und bei Wärme wird diese Reaktion beschleunigt.
Das Gas löst sich auch gut in Aceton, Benzol, Ethylalkohol und Diethylether.
Beim Erhitzen auf 571 °C zersetzt es sich, gelegentlich unter Explosion.
Mit Sauerstoff und mit Metallpulvern wie Magnesium, Zink oder sogar mit
Silber reagiert es ebenfalls explosionsartig. Schon ab 400 °C findet
unter Wärmeentwicklung eine Isomerisierung zu Acetaldehyd statt. Ethylenoxid
ist sehr reaktionsfähig und addiert die meisten Wasserstoffverbindungen
nach diesem Prinzip:
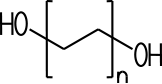
Ethylenoxid neigt gerne zur Polymerisation.
In flüssiger Form oder bei der Zugabe von Zinn(IV)-chlorid und wenig
Wasser reagiert es gerne in einer Kettenpolymerisation exotherm zu
Polyethylenglykol. Man erhält flüssige
oder wachsartige Produkte, die als Lösungsmittel, als Extraktionsmittel
oder als Weichmacher verwendet werden.
|
| Herstellung Die industrielle Herstellung
erfolgt durch die Oxidation von Ethen mit Sauerstoff an einem Silberkontakt bei etwa 250 °C unter Druck:
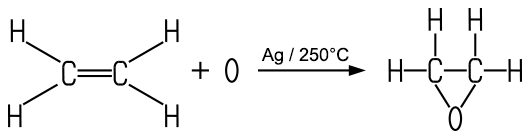 |
| Verwendung Ethylenoxid ist ein wichtiges
Zwischenprodukt in der chemischen Industrie: Es dient zur Herstellung
von Ethylengylcol, Polyethylenglykol, Dioxan, Ethylenglykolether, Polyethylenglykolether,
Ethanolamin und Acrylnitril. Ethylenoxid wird zur Indigosynthese benötigt. Es wird auch als
Schädlingsbekämpfungsmittel eingesetzt. |