|
|
||||
|
Die Schwefelsäure
ist in der chemischen Industrie ein bedeutender Rohstoff zur Herstellung
von Stoffen wie Sulfate, Düngemittel
oder Waschmittel. Das Kontaktverfahren
zur Gewinnung von Schwefelsäure wurde durch die deutschen Chemiker
Clemens Winkler (1838–1904) und Rudolf Knietsch (1854–1906) entwickelt.
Als Ausgangsprodukt eignet sich flüssiger Schwefel, der aus der Aufbereitung
von Erdgas stammt und eine Temperatur von etwa 135 °C besitzt. Die Synthese der Schwefelsäure
erfolgt in mehreren Schritten:
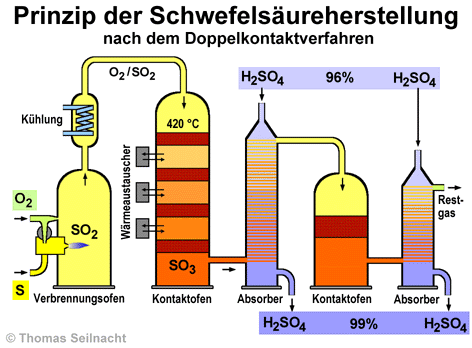
1. Schritt
Im Verbrennungsofen verbrennt der flüssige Schwefel mit Luftsauerstoff und mit Hilfe eines Brenners. Er oxidiert dabei zu Schwefeldioxid: Schwefel + Sauerstoff S + O2 Die nachgeschaltete Kühlung (auch Abhitzer) bringt das Gasgemisch auf die optimale Temperatur. Diese beträgt im oberen Teil des nachgeschalteten Kontaktofens etwa 420 °C. 2. Schritt Im Kontaktofen wird das entstandene Schwefeldioxid mit dem im Gasgemisch enthaltenen Sauerstoff weiter oxidiert, dabei entsteht Schwefeltrioxid. Schwefeldioxid + Sauerstoff 2 SO2 + O2 Damit diese Reaktion abläuft, wird das Gasgemisch durch Siebböden (Horden) mit einer Aufschüttung eines Katalysators geleitet. Es sind mehrere solcher Horden hintereinander angeordnet. Die Reaktion wird durch den Einsatz von Katalysatoren wie Vanadiumoxid und durch einen exakt berechneten Anteil an Sauerstoff im Überschuss begünstigt. Nach dem Prinzip von Le Chatelier sinkt mit steigender Temperatur der Anteil an Schwefeltrioxid bei diesem chemischen Gleichgewicht, daher erweist sich eine Arbeitstemperatur von 420 bis 440 °C optimal. Bei zu niedrigen Temperaturen würde wiederum die Reaktionsgeschwindigkeit abnehmen. Am Ausgang der Siebböden kann die Temperatur auf bis zu 620 °C ansteigen. Daher sind die einzelnen Horden durch Wärmeaustauscher voneinander getrennt. Die Wärmeaustauscher leiten überschüssige Wärme ab. 3. Schritt Im Absorber wird das Schwefeltrioxid mit 96%iger Schwefelsäure vermischt. Das Schwefeltrioxid reagiert mit dem Wasseranteil in der leicht verdünnten Säure: Schwefeltrioxid + Wasser SO3 + H2O Die so gebildete Schwefelsäure lässt die Konzentration des Gemisches insgesamt auf bis zu 99% ansteigen. Das Zugeben einer leicht verdünnten, 96%igen Säure verhindert das Entstehen von Dischwefelsäure H2S2O7. Der dabei entstehende Nebel würde sich nur noch schwer abscheiden lassen. Dischwefelsäure würde entstehen, wenn Schwefeltrioxid in konzentrierte Schwefelsäure eingeleitet wird: SO3 + H2SO4 Als „Oleum“ (auch rauchende Schwefelsäure) wird eine Mischung von Schwefelsäure und Dischwefelsäure bezeichnet. Manche Anlagen stellen ganz bewusst Oleum her, da das Produkt für einige organische Synthesen benötigt wird. Dann werden bei der Zwischenabsorption zwei Absorber eingesetzt. 4. Schritt Im ersten Kontaktofen wird nicht alles Schwefeldioxid vollständig umgesetzt. Beim Doppelkontaktverfahren wird das verbleibende Schwefeldioxid nach dem Durchgang durch den Zwischenabsorber nochmals über eine Kontaktschicht geleitet. Im Endabsorber wird das in dieser letzten Kontaktschicht entstehende Schwefeltrioxid in Schwefelsäure gelöst. Moderne Anlagen erreichen eine Umsetzung des Schwefeldioxids von mindestens 99,8%. Serienbilder zur Schwefelsäuresynthese
Zur Schwefelsäuresynthese liegt eine Serie in 12 Bildern zur Lösungskontrolle vor. Die Lösungen werden beim Durchklicken im Vollbildmodus nach und nach eingeblendet. Die Serie kann zur Erarbeitung des Arbeitsblattes verwendet werden. Es liegt auch ein Text vor, den man gleichzeitig vorlesen kann.   Serie starten Serie startenArbeitsblatt doc docx pdf Vorlesetext doc docx pdf Schwefelsäuresynthese im Modellversuch
Weitere Informationen Schwefeldioxid Schwefelsäure Buch individuell erstellen: Basis-Text Schwefelsäure  
> Inhaltsverzeichnis |