Unstabilisiertes Wasserstoffperoxid neigt zur spontanen Explosion. Im Schullabor sollte nur die stabilisierte, 30%ige Wasserstoffperoxid-Lösung gelagert werden. Die Aufbewahrung erfolgt in einer braunen Flasche mit Entlüftungsventil an einem lichtgeschützten und kühlen Ort. Für Schülerversuche in der Sekundarstufe I wird empfohlen, nur frisch angesetzte Lösungen bis zu einer Konzentration von 10% einzusetzen. Reines Wasserstoffperoxid oder eine konzentrierte Lösung gilt nicht als Explosivstoff, kann aber zur Herstellung derartiger Stoffe verwendet werden (Hinweis). Der Privatbesitz von Wasserstoffperoxid ist in Deutschland nur bis zu einer Konzentration von 12 % erlaubt, in Konzentrationen darüber ist es verboten. In der Schweiz und in der EU ist ein Genehmigungsverfahren für Konzentrationen bis 35 % vorgeschrieben.
Gefährdungsbeurteilung Deutschland (auch EU)
GBU Experimentieren mit Wasserstoffperoxid (bis 30%)
GBU Elefantenzahnpasta
Sicherheitsbetrachtung Schweiz
GBU Experimentieren mit Wasserstoffperoxid (bis 30%)
GBU Elefantenzahnpasta
Wasserstoffperoxid
H2O2
CAS 7722-84-1
Wasserstoffperoxid
Hydrogen peroxide
34,015 g/mol
0,5 ml/m3 (TRGS 900)
+11,62
1,44 g/cm3
−0,43 °C
+150,2 °C
in jedem Verhältnis mischbar
0,5 ml/m3 (TRGS 900)
+11,62
1,44 g/cm3
−0,43 °C
+150,2 °C
in jedem Verhältnis mischbar
Klare, in sehr hohen Konzentrationen leicht bläuliche Flüssigkeit
Braune Flasche mit Entlüftungsventil oder nicht fest sitzendem Stopfen; an kühlem Ort aufbewahren
Braune Flasche mit Entlüftungsventil oder nicht fest sitzendem Stopfen; an kühlem Ort aufbewahren

Gefahrenklassen + Kategorie
Oxidierende Flüssigkeiten 1 *
Korrosiv gegenüber Metallen 1
Akute Toxizität oral 4 *
Akute Toxizität inhalativ 4 *
Ätz-/Reizwirkung auf die Haut 1A *
Spez. Zielorgan-Toxizität 3 *
(* Abstufungen bei Verdünnungen)
Oxidierende Flüssigkeiten 1 *
Korrosiv gegenüber Metallen 1
Akute Toxizität oral 4 *
Akute Toxizität inhalativ 4 *
Ätz-/Reizwirkung auf die Haut 1A *
Spez. Zielorgan-Toxizität 3 *
(* Abstufungen bei Verdünnungen)
HP-Sätze (siehe Hinweis)
H 271, 290, 302, 314, 332, 335, 412
P 220, 235, 280.1–4, 301+330+331, 303+361+353, 305+351+338+310
Diese Empfehlungen gelten für Konzentrationen über 70%
Entsorgung besondere Hinweise
H 271, 290, 302, 314, 332, 335, 412
P 220, 235, 280.1–4, 301+330+331, 303+361+353, 305+351+338+310
Diese Empfehlungen gelten für Konzentrationen über 70%
Entsorgung besondere Hinweise
Wirkung auf den menschlichen Körper
Wasserstoffperoxid reizt und verätzt auch in verdünnter Form Augen, Haut und Schleimhäute. Die hellen Flecken an der Haut, die bei einem Kontakt auftreten, sind ein Resultat des bei der Zersetzung im Gewebe entstehenden Sauerstoffs, der bleichend wirkt. Beim Einatmen der Dämpfe können Entzündungen der Schleimhäute bis hin zu einem Lungenödem auftreten. Bei der oralen Aufnahme entstehen Verätzungen an der Speiseröhre. Durch eine Freisetzung von Sauerstoff im Magen kann es zu einer Überdehnung kommen. Bei einer Schaumbildung besteht dann die Gefahr durch Ersticken. Bei der Aufnahme ins Blut durch Hautresorption oder über den Magen treten Symptome wie Kopfschmerzen, Schwindel, Erbrechen, Durchfall, Krämpfe oder allgemeine Kreislaufstörungen auf.

Ätz- und Bleichwirkung einer verdünnten Wasserstoffperoxid-Lösung auf der Haut.
Chemisch-physikalische Eigenschaften
Reines, wasserfreies Wasserstoffperoxid ist eine klare Flüssigkeit, die in dicken Schichten leicht bläulich erscheint. Im Vergleich zum Wasser ist die Viskosität höher. Die Flüssigkeit erstarrt bei −0,43 °C zu nadelförmigen, farblosen Kristallen. Sie ist in jedem Verhältnis mischbar mit Wasser. Wasserstoffperoxid kann bei vermindertem Druck destilliert werden, ohne dass eine Zersetzung erfolgt. Hoch konzentrierte Lösungen können aber bei Erwärmung und vor allem in Anwesenheit von Schwermetall-Verunreinigungen spontan explodieren. Aufgrund dieser Eigenschaft sind im Handel verdünnte und stabilisierte Lösungen erhältlich.
Will man im Schullabor verdünnte Lösungen selbst herstellen und verwenden, müssen diese immer frisch angesetzt werden. Beim Verdünnen mit destilliertem Wasser fehlen die Stabilisatoren, und auch feinste Verunreinigungen – zum Beispiel mit Staub oder mit Eisen-Ionen – können die Zersetzung beschleunigen. Auch die verdünnten Lösungen wirken bleichend und verätzen die Haut. Aufgrund der stark oxidierenden Wirkung eignet sich Wasserstoffperoxid zum Bleichen von Haaren. Auf Kaliumpermanganat, Chlorkalk oder Silber(I)-oxid wirkt es reduzierend, die meisten anderen Stoffe werden durch Wasserstoffperoxid oxidiert, zum Beispiel Schweflige Säure zu Schwefelsäure oder Alkohole zu Aldehyden.

Gibt man eine Wasserstoffperoxid-Lösung auf eine aufgeschnittene Kartoffel,
dann wird eine katalytische Reaktion ausgelöst, und das Wasserstoffperoxid zerfällt.
Die handelsübliche 30%-ige Lösung zerfällt unter Licht- und Wärmeeinwirkung in Gegenwart von Katalysatoren wie Staub, feinverteiltes Gold, Silber oder Platin, Laugen und Biokatalysatoren zu Wasser und Sauerstoff. Aus diesem Grund werden bei der im Handel erhältlichen Flüssigkeit Stabilisatoren wie Natriumphosphat oder Phosphorsäure zugesetzt, die diesen Zerfall verhindern.
Wasserstoffperoxid reagiert mit Wasser unter Bildung weniger Hydronium-Ionen H3O+. Das Gleichgewicht liegt stark bei den Ausgangsstoffen, daher ist Wasserstoffperoxid nur eine sehr schwache Säure:
Wasserstoffperoxid-Salze zerfallen bereits mit Wasser fast vollständig zu Wasserstoffperoxid und den entsprechenden Metallhydroxiden. Von technischer Bedeutung sind Bleichmittel wie Natriumperoxid Na2O2 und Bariumperoxid BaO2. Natriumperoxid wird durch das Verbrennen von Natrium an der Luft hergestellt. Bariumperoxid eignet sich als Sauerstoffträger beim Entzünden von Thermit mit einem Zündmittel. Gibt man zum Wasserstoffperoxid Mangan(IV)-oxid, zersetzt es sich unter Abgabe von Sauerstoff. Mangan(IV)-oxid wirkt dabei als Katalysator. Die Sauerstoff-Darstellung gelingt auch durch das Eintauchen eines platinierten Nickelblechs oder durch die Zugabe von Eisen(III)-Salzen zum Wasserstoffperoxid.
Nachweis
Der Nachweis des Wasserstoffperoxids kann durch die Reaktion mit einer durch heiße, konzentrierte Schwefelsäure aufgeschlossene Titansalz-Lösung erfolgen. Dabei entsteht ein gelboranger Komplex. Die Reaktion mit Wasserstoffperoxid dient umgekehrt auch zum Nachweis von Titan. Es entsteht dabei ein Hydroxoperoxotitan(IV)-Ion, das die gelborange Färbung verursacht:
[Ti(OH)3]+ + H2O2 [Ti(O2)OH]+ + 2 H2O
[Ti(O2)OH]+ + 2 H2O
Wasserstoffperoxid in der Natur
Wasserstoffperoxid ist ein Zwischenprodukt im Stoffwechsel. Es entsteht in bestimmten Zellorganellen, die Peroxisomen oder Mikrobodies genannt werden. Durch Beteiligung oxidierend wirkender Enzyme, den Oxidasen, wird aus Wasserstoff und Sauerstoff Wasserstoffperoxid gebildet. Dieses wird im Stoffwechsel als Oxidationsmittel eingesetzt. Katalytisch wirkende Enzyme, die Katalasen, bauen das Wasserstoffperoxid in den Peroxisomen wieder ab. Die Funktion dieser Zellorganellen besteht darin, Wasserstoffperoxid abzubauen, das außerhalb der Organellen gebildet wird und dort als Zellgift Zellmembranen zerstören kann. Wasserstoffperoxid wirkt keimtötend und kann als Desinfektionsmittel eingesetzt werden. Die weibliche Eizelle produziert bei der Befruchtung kurz nach dem Eindringen des ersten Spermiums Wasserstoffperoxid und tötet damit die nachfolgenden Spermien ab. Der Bombardierkäfer nutzt Wasserstoffperoxid zusammen mit Hydrochinon zur Herstellung einer wirksamen Verteidigungswaffe.
Wasserstoffperoxid reizt und verätzt auch in verdünnter Form Augen, Haut und Schleimhäute. Die hellen Flecken an der Haut, die bei einem Kontakt auftreten, sind ein Resultat des bei der Zersetzung im Gewebe entstehenden Sauerstoffs, der bleichend wirkt. Beim Einatmen der Dämpfe können Entzündungen der Schleimhäute bis hin zu einem Lungenödem auftreten. Bei der oralen Aufnahme entstehen Verätzungen an der Speiseröhre. Durch eine Freisetzung von Sauerstoff im Magen kann es zu einer Überdehnung kommen. Bei einer Schaumbildung besteht dann die Gefahr durch Ersticken. Bei der Aufnahme ins Blut durch Hautresorption oder über den Magen treten Symptome wie Kopfschmerzen, Schwindel, Erbrechen, Durchfall, Krämpfe oder allgemeine Kreislaufstörungen auf.
Ätz- und Bleichwirkung einer verdünnten Wasserstoffperoxid-Lösung auf der Haut.
Chemisch-physikalische Eigenschaften
Reines, wasserfreies Wasserstoffperoxid ist eine klare Flüssigkeit, die in dicken Schichten leicht bläulich erscheint. Im Vergleich zum Wasser ist die Viskosität höher. Die Flüssigkeit erstarrt bei −0,43 °C zu nadelförmigen, farblosen Kristallen. Sie ist in jedem Verhältnis mischbar mit Wasser. Wasserstoffperoxid kann bei vermindertem Druck destilliert werden, ohne dass eine Zersetzung erfolgt. Hoch konzentrierte Lösungen können aber bei Erwärmung und vor allem in Anwesenheit von Schwermetall-Verunreinigungen spontan explodieren. Aufgrund dieser Eigenschaft sind im Handel verdünnte und stabilisierte Lösungen erhältlich.
| Konzentration, Massenprozent |
Konzentration, Stoffmenge |
Bezeichnung |
Dichte bei 20 °C |
| 100 % | 42,63 mol/l | „rein“ | 1,45 g/cm3 |
| 35 % | 11,63 mol/l | „konzentriert“ | 1,13 g/cm3 |
| 30 % | 9,79 mol/l |
„konzentriert“ | 1,11 g/cm3 |
| 10 % | 2,97 mol/l | „verdünnt“ | 1,01 g/cm3 |
| 3 % | 0,88 mol/l | „verdünnt“ | 1,00 g/cm3 |
Will man im Schullabor verdünnte Lösungen selbst herstellen und verwenden, müssen diese immer frisch angesetzt werden. Beim Verdünnen mit destilliertem Wasser fehlen die Stabilisatoren, und auch feinste Verunreinigungen – zum Beispiel mit Staub oder mit Eisen-Ionen – können die Zersetzung beschleunigen. Auch die verdünnten Lösungen wirken bleichend und verätzen die Haut. Aufgrund der stark oxidierenden Wirkung eignet sich Wasserstoffperoxid zum Bleichen von Haaren. Auf Kaliumpermanganat, Chlorkalk oder Silber(I)-oxid wirkt es reduzierend, die meisten anderen Stoffe werden durch Wasserstoffperoxid oxidiert, zum Beispiel Schweflige Säure zu Schwefelsäure oder Alkohole zu Aldehyden.
Gibt man eine Wasserstoffperoxid-Lösung auf eine aufgeschnittene Kartoffel,
dann wird eine katalytische Reaktion ausgelöst, und das Wasserstoffperoxid zerfällt.
Die handelsübliche 30%-ige Lösung zerfällt unter Licht- und Wärmeeinwirkung in Gegenwart von Katalysatoren wie Staub, feinverteiltes Gold, Silber oder Platin, Laugen und Biokatalysatoren zu Wasser und Sauerstoff. Aus diesem Grund werden bei der im Handel erhältlichen Flüssigkeit Stabilisatoren wie Natriumphosphat oder Phosphorsäure zugesetzt, die diesen Zerfall verhindern.
2 H2O2  2 H2O + O2 ΔH = −98,3 kJ/mol
2 H2O + O2 ΔH = −98,3 kJ/mol
Wasserstoffperoxid reagiert mit Wasser unter Bildung weniger Hydronium-Ionen H3O+. Das Gleichgewicht liegt stark bei den Ausgangsstoffen, daher ist Wasserstoffperoxid nur eine sehr schwache Säure:
H2O2 + H2O  HO2− + H3O+
HO2− + H3O+
Wasserstoffperoxid-Salze zerfallen bereits mit Wasser fast vollständig zu Wasserstoffperoxid und den entsprechenden Metallhydroxiden. Von technischer Bedeutung sind Bleichmittel wie Natriumperoxid Na2O2 und Bariumperoxid BaO2. Natriumperoxid wird durch das Verbrennen von Natrium an der Luft hergestellt. Bariumperoxid eignet sich als Sauerstoffträger beim Entzünden von Thermit mit einem Zündmittel. Gibt man zum Wasserstoffperoxid Mangan(IV)-oxid, zersetzt es sich unter Abgabe von Sauerstoff. Mangan(IV)-oxid wirkt dabei als Katalysator. Die Sauerstoff-Darstellung gelingt auch durch das Eintauchen eines platinierten Nickelblechs oder durch die Zugabe von Eisen(III)-Salzen zum Wasserstoffperoxid.
Nachweis
Der Nachweis des Wasserstoffperoxids kann durch die Reaktion mit einer durch heiße, konzentrierte Schwefelsäure aufgeschlossene Titansalz-Lösung erfolgen. Dabei entsteht ein gelboranger Komplex. Die Reaktion mit Wasserstoffperoxid dient umgekehrt auch zum Nachweis von Titan. Es entsteht dabei ein Hydroxoperoxotitan(IV)-Ion, das die gelborange Färbung verursacht:
[Ti(OH)3]+ + H2O2
Wasserstoffperoxid in der Natur
Wasserstoffperoxid ist ein Zwischenprodukt im Stoffwechsel. Es entsteht in bestimmten Zellorganellen, die Peroxisomen oder Mikrobodies genannt werden. Durch Beteiligung oxidierend wirkender Enzyme, den Oxidasen, wird aus Wasserstoff und Sauerstoff Wasserstoffperoxid gebildet. Dieses wird im Stoffwechsel als Oxidationsmittel eingesetzt. Katalytisch wirkende Enzyme, die Katalasen, bauen das Wasserstoffperoxid in den Peroxisomen wieder ab. Die Funktion dieser Zellorganellen besteht darin, Wasserstoffperoxid abzubauen, das außerhalb der Organellen gebildet wird und dort als Zellgift Zellmembranen zerstören kann. Wasserstoffperoxid wirkt keimtötend und kann als Desinfektionsmittel eingesetzt werden. Die weibliche Eizelle produziert bei der Befruchtung kurz nach dem Eindringen des ersten Spermiums Wasserstoffperoxid und tötet damit die nachfolgenden Spermien ab. Der Bombardierkäfer nutzt Wasserstoffperoxid zusammen mit Hydrochinon zur Herstellung einer wirksamen Verteidigungswaffe.
Die erstmalige Synthese gelang dem französischen Chemiker Louis Jacques Thénard (1777–1857) im Jahr 1818 als er Bariumperoxid BaO2 mit Schwefelsäure versetzte:
Bis 1945 wurde Wasserstoffperoxid durch die Elektrolyse von Schwefelsäure dargestellt. An der Anode oxidiert die Schwefelsäure unter Wasserstoffbildung zu Peroxodischwefelsäure (Reaktion 1). Durch Hydrolyse dieses Produkts erhält man wieder Schwefelsäure und Wasserstoffperoxid (Reaktion 2). Dieses Verfahren war während des Zweiten Weltkrieges für den Bau der V2-Rakete von Bedeutung.
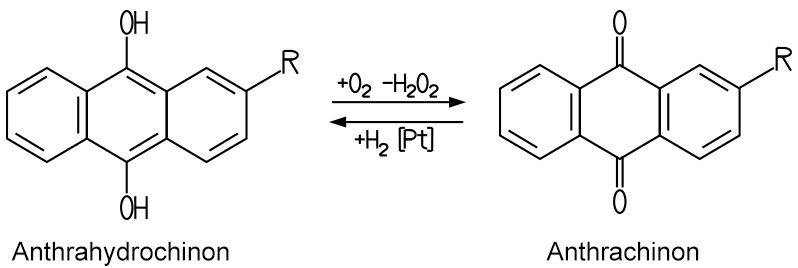
Heute erfolgt die industrielle Herstellung nach dem Anthrachinonverfahren. Dabei wird Luftsauerstoff bei Temperaturen um 30 bis 80 °C und fünf Bar Druck unter Einsatz des Hydrierungsmittels Anthrahydrochinon hydriert. Das gewonnene Anthrachinon wird mit Hilfe eines Platin-Katalysators und Wasserstoff wieder zu Anthrahydrochinon reduziert:
BaO2 + H2SO4  BaSO4 + H2O2
BaSO4 + H2O2
Bis 1945 wurde Wasserstoffperoxid durch die Elektrolyse von Schwefelsäure dargestellt. An der Anode oxidiert die Schwefelsäure unter Wasserstoffbildung zu Peroxodischwefelsäure (Reaktion 1). Durch Hydrolyse dieses Produkts erhält man wieder Schwefelsäure und Wasserstoffperoxid (Reaktion 2). Dieses Verfahren war während des Zweiten Weltkrieges für den Bau der V2-Rakete von Bedeutung.
Reaktion 1: 2 H2SO4  H2S2O8 + H2
H2S2O8 + H2
Reaktion 2: H2S2O8 + 2 H2O  H2O2 + 2 H2SO4
H2O2 + 2 H2SO4
Heute erfolgt die industrielle Herstellung nach dem Anthrachinonverfahren. Dabei wird Luftsauerstoff bei Temperaturen um 30 bis 80 °C und fünf Bar Druck unter Einsatz des Hydrierungsmittels Anthrahydrochinon hydriert. Das gewonnene Anthrachinon wird mit Hilfe eines Platin-Katalysators und Wasserstoff wieder zu Anthrahydrochinon reduziert:

Wasserstoffperoxid wird zur Herstellung von Bleichmitteln in Waschmitteln verwendet. Es dient auch zum Bleichen von Papier, Zellstoff, Holz oder Textilien. Die chemische Industrie nützt es als Rohstoff zur Herstellung von Glycerin, Weichmachern, Peroxiden oder Epoxiden. Bei der Herstellung von Wafern aus Silicium wird ein Gemisch aus Wasserstoffperoxid und Schwefelsäure benutzt, um die Oberfläche zu reinigen und eine sehr dünne Oxidschicht anzubringen. Im Labor ist Wasserstoffperoxid ein beliebtes Oxidationsmittel.
Früher setzte man Wasserstoffperoxid vereinzelt als oxidierend wirkende Komponente in Raketentreibstoffen ein, zum Beispiel in der britischen Weltraum-Rakete „Black Arrow“, die den ersten britischen Satelliten in eine Erdumlaufbahn brachte. In der deutschen V2-Rakete zersetzte man Wasserstoffperoxid mit Kaliumpermanganat, um damit ein Treibgas für die Treibstoffpumpen zu erzeugen. Der eigentliche Raketentreibstoff in der V2 war Ethanol, der mit flüssigem Sauerstoff vermischt und gezündet wurde. Heute noch dient Wasserstoffperoxid als Treibstoff für U-Boote und Torpedos. Wasserstoffperoxid kann auch zur Herstellung des Explosivstoffs Triacetontriperoxid (TATP) verwendet werden. Dieser Sprengstoff wurde zum Beispiel bei den Terroranschlägen im März 2016 in Brüssel eingesetzt.
Eine 3%ige Lösung eignet sich zum Desinfizieren im Haushaltsbereich, medizinische Lösungen zum Gurgeln enthalten 0,3% Wasserstoffperoxid. Bei der Abfüllung von PET-Flaschen in der Getränkeindustrie wird eine 35%ige Lösung eingesetzt, um das Produkt keimfrei zu halten. Aber auch zahlreiche andere Verpackungen, beispielsweise für Milch oder Milchprodukte, werden so vorbehandelt. Auch Schimmelbefall im Innenraum kann mit Wasserstoffperoxid bekämpft werden. Die Medizin nutzt es zum Sterilisieren von Geräten.

Verdünnte Wasserstoffperoxid-Lösungen eignen sich zum Blondieren.
Schon in der Antike versuchten die Frauen, ihre Haare mit alkalischen Lösungen aus Holzasche, Kalk oder Soda aufzuhellen. Bei den Adligen wurden früher auch Pulver aus Gold, Silber oder Kupfer verwendet, um das Haar hell oder glänzend erscheinen zu lassen. Das Blondieren von Haaren mit Wasserstoffperoxid in 3%iger Konzentration zeigte erstmals der englische Pharmazeut E. H. Thiellay im Jahr 1867 anlässlich einer Ausstellung in Paris. Beim Blondieren zerstört das Wasserstoffperoxid durch Oxidation das Farbpigment Melanin, das für die Haarfarbe verantwortlich ist. Die Blondierung darf nur durch Fachpersonal vorgenommen werden, da bei unsachgemäßer Anwendung die Haarwurzeln zerstört werden können. In den käuflichen Blondierpulvern sind auch Ammoniak und Persulfate enthalten, die das Haar aufquellen lassen und so aufnahmefähig für das Blondiermittel machen. Das Auswaschen erfolgt mit einem sauren Shampoo, damit der natürliche pH-Wert des Haares wieder hergestellt wird.

Im Standzylinder befindet sich eine konzentrierte Kaliumiodid-Lösung, die mit Geschirrspülmittel versetzt wurde.
Gibt man eine 30%ige Wasserstoffperoxid-Lösung hinzu, erfolgt eine Reaktion mit starker Volumenzunahme.
Film
Aus dem Chemieunterricht ist die Reaktion von Wasserstoffperoxid mit einer konzentrierten Kaliumiodid-Lösung als Herstellung einer „Elefantenzahnpasta“ bekannt. Dabei reagiert eine 30%ige Wasserstoffperoxid-Lösung mit einer konzentrierten Kaliumiodid-Lösung. Als Reaktionsbehälter dient ein schmaler, hoher Standzylinder, dem zuvor Geschirrspülmittel zugesetzt wurde. Das Kaliumiodid wirkt als Katalysator. Dabei wird das gesamte Wasserstoffperoxid in einer schnellen Reaktion in Sauerstoff und Wasser gespalten. Die Reaktion verläuft unter Wärmeentwicklung stark exotherm, so dass die entstehenden, gasförmigen Produkte mit dem Geschirrspülmittel zu einem gelben Schaum vermischt werden, dessen Volumen sich enorm vergrößert. Die gelbe Farbe im Schaum weist auf die Bildung von Iod hin.
Weitere Infos und Medien
Schülerversuche mit Wasserstoffperoxid
Beschreibung und sichere Durchführung der Demonstration Elefantenzahnpasta
Buch individuell erstellen: Basis-Text Wasserstoffperoxid


> Inhaltsverzeichnis
Früher setzte man Wasserstoffperoxid vereinzelt als oxidierend wirkende Komponente in Raketentreibstoffen ein, zum Beispiel in der britischen Weltraum-Rakete „Black Arrow“, die den ersten britischen Satelliten in eine Erdumlaufbahn brachte. In der deutschen V2-Rakete zersetzte man Wasserstoffperoxid mit Kaliumpermanganat, um damit ein Treibgas für die Treibstoffpumpen zu erzeugen. Der eigentliche Raketentreibstoff in der V2 war Ethanol, der mit flüssigem Sauerstoff vermischt und gezündet wurde. Heute noch dient Wasserstoffperoxid als Treibstoff für U-Boote und Torpedos. Wasserstoffperoxid kann auch zur Herstellung des Explosivstoffs Triacetontriperoxid (TATP) verwendet werden. Dieser Sprengstoff wurde zum Beispiel bei den Terroranschlägen im März 2016 in Brüssel eingesetzt.
Eine 3%ige Lösung eignet sich zum Desinfizieren im Haushaltsbereich, medizinische Lösungen zum Gurgeln enthalten 0,3% Wasserstoffperoxid. Bei der Abfüllung von PET-Flaschen in der Getränkeindustrie wird eine 35%ige Lösung eingesetzt, um das Produkt keimfrei zu halten. Aber auch zahlreiche andere Verpackungen, beispielsweise für Milch oder Milchprodukte, werden so vorbehandelt. Auch Schimmelbefall im Innenraum kann mit Wasserstoffperoxid bekämpft werden. Die Medizin nutzt es zum Sterilisieren von Geräten.
Verdünnte Wasserstoffperoxid-Lösungen eignen sich zum Blondieren.
Schon in der Antike versuchten die Frauen, ihre Haare mit alkalischen Lösungen aus Holzasche, Kalk oder Soda aufzuhellen. Bei den Adligen wurden früher auch Pulver aus Gold, Silber oder Kupfer verwendet, um das Haar hell oder glänzend erscheinen zu lassen. Das Blondieren von Haaren mit Wasserstoffperoxid in 3%iger Konzentration zeigte erstmals der englische Pharmazeut E. H. Thiellay im Jahr 1867 anlässlich einer Ausstellung in Paris. Beim Blondieren zerstört das Wasserstoffperoxid durch Oxidation das Farbpigment Melanin, das für die Haarfarbe verantwortlich ist. Die Blondierung darf nur durch Fachpersonal vorgenommen werden, da bei unsachgemäßer Anwendung die Haarwurzeln zerstört werden können. In den käuflichen Blondierpulvern sind auch Ammoniak und Persulfate enthalten, die das Haar aufquellen lassen und so aufnahmefähig für das Blondiermittel machen. Das Auswaschen erfolgt mit einem sauren Shampoo, damit der natürliche pH-Wert des Haares wieder hergestellt wird.

Im Standzylinder befindet sich eine konzentrierte Kaliumiodid-Lösung, die mit Geschirrspülmittel versetzt wurde.
Gibt man eine 30%ige Wasserstoffperoxid-Lösung hinzu, erfolgt eine Reaktion mit starker Volumenzunahme.
Film
Aus dem Chemieunterricht ist die Reaktion von Wasserstoffperoxid mit einer konzentrierten Kaliumiodid-Lösung als Herstellung einer „Elefantenzahnpasta“ bekannt. Dabei reagiert eine 30%ige Wasserstoffperoxid-Lösung mit einer konzentrierten Kaliumiodid-Lösung. Als Reaktionsbehälter dient ein schmaler, hoher Standzylinder, dem zuvor Geschirrspülmittel zugesetzt wurde. Das Kaliumiodid wirkt als Katalysator. Dabei wird das gesamte Wasserstoffperoxid in einer schnellen Reaktion in Sauerstoff und Wasser gespalten. Die Reaktion verläuft unter Wärmeentwicklung stark exotherm, so dass die entstehenden, gasförmigen Produkte mit dem Geschirrspülmittel zu einem gelben Schaum vermischt werden, dessen Volumen sich enorm vergrößert. Die gelbe Farbe im Schaum weist auf die Bildung von Iod hin.
Weitere Infos und Medien
Schülerversuche mit Wasserstoffperoxid
Beschreibung und sichere Durchführung der Demonstration Elefantenzahnpasta
Buch individuell erstellen: Basis-Text Wasserstoffperoxid


> Inhaltsverzeichnis
© Thomas Seilnacht / Benutzerhandbuch / Lizenzbestimmungen / Impressum / Datenschutz / Literaturquellen