Hält
man einen brennenden Holzspan an ein Gemisch aus Eisen- und
Schwefel-Pulver, zündet die Mischung an einer Stelle. Die Reaktion
läuft danach von alleine weiter, bis das ganze Gemisch reagiert
hat.
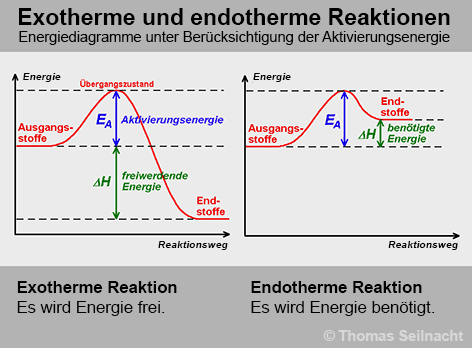
Viele chemische Reaktionen laufen nicht von selbst ab, selbst wenn sie ein großes Potenzial haben, um Energie abgeben zu können. Durch die Zugabe von Energie werden die vorhandenen chemischen Systeme angeregt, sich neu zu ordnen und bilden dabei einen (nicht stabilen) Übergangszustand, in dem sich die Komponenten in einem aktivierten Zustand befinden. Als Aktivierungsenergie wird derjenige Energiebetrag bezeichnet, der notwendig ist, um die chemische Reaktion einzuleiten. Im Gesamtsystem ist dann so viel kinetische Energie vorhanden, dass die chemische Reaktion abläuft.
Diese Beispiele zeigen Möglichkeiten auf, wie Energie zur Anregung dient:
Viele chemische Reaktionen laufen nicht von selbst ab, selbst wenn sie ein großes Potenzial haben, um Energie abgeben zu können. Durch die Zugabe von Energie werden die vorhandenen chemischen Systeme angeregt, sich neu zu ordnen und bilden dabei einen (nicht stabilen) Übergangszustand, in dem sich die Komponenten in einem aktivierten Zustand befinden. Als Aktivierungsenergie wird derjenige Energiebetrag bezeichnet, der notwendig ist, um die chemische Reaktion einzuleiten. Im Gesamtsystem ist dann so viel kinetische Energie vorhanden, dass die chemische Reaktion abläuft.
Diese Beispiele zeigen Möglichkeiten auf, wie Energie zur Anregung dient:
-
Eine Knallerbse explodiert durch den Schlag, der beim Aufprall auf den Boden entsteht.
-
Beim Mischen eines explosionsgefährlichen Gemisches aus rotem Phosphor und Kaliumchlorat führt die dabei entstehende Reibung zu einer vorzeitigen Explosion.
-
Ein Gemisch aus Chlorgas und Wasserstoff lässt sich mit Hilfe eines hellen Lichtblitzes zur Explosion bringen.
-
Ein Gemisch aus Zink-Staub und Schwefel-Pulver verpufft nach Berührung mit einem heißen Draht.
Die Differenz der Energieniveaus zwischen Ausgangsstoffen (Edukten) und Endstoffen (Produkten) ist die freie Enthalpie ΔGR. Diese wird auch Gibbs-Energie genannt. Sie kann aus dieser Formel abgeleitet werden:
ΔG = ΔH − T × ΔS
In der Formel wird die Enthalpie ΔH um das Produkt aus der Temperatur T und der Entropie ΔS vermindert. Bei exergonischen Reaktionen ist ΔG < 0, bei endergonischen Reaktionen ist ΔG > 0.
ΔG = ΔH − T × ΔS
In der Formel wird die Enthalpie ΔH um das Produkt aus der Temperatur T und der Entropie ΔS vermindert. Bei exergonischen Reaktionen ist ΔG < 0, bei endergonischen Reaktionen ist ΔG > 0.
Ergänzende Informationen
Entropie
Diashow: Eisen reagiert mit Schwefel
Demonstrationen zur Aktivierungsenergie
Buch individuell erstellen: Basis-Text Aktivierungsenergie


> Inhaltsverzeichnis