Methan
CH4
CAS 74-82-8
Methan
Methane
16,043 g/mol
keine Angaben
0,7175 g/l (Gas, 0 °C, 1013 hPa)
(Methan zu Luft = 0,56)
−182,475 °C
−161,5 °C
Konz. bei 25 °C 0,0277g/l
5 bis 15 Vol.-% (Luft)
+537 °C
keine Angaben
0,7175 g/l (Gas, 0 °C, 1013 hPa)
(Methan zu Luft = 0,56)
−182,475 °C
−161,5 °C
Konz. bei 25 °C 0,0277g/l
5 bis 15 Vol.-% (Luft)
+537 °C
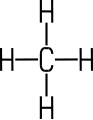
Farbloses Gas

Im Laborhandel sind Druckgasdosen mit dem reinen Gas erhältlich. Bei einem Erdgasanschluss kann das Gas unter Beachtung der Sicherheitsvorkehrungen entnommen werden. Dieses Gas ist jedoch mit Ethan und anderen Komponenten verunreinigt. Methan-Luft-Gemische sind explosiv. Mit brennbaren Gasen darf nur gearbeitet werden, wenn eine aktive Raumlüftung eingeschaltet ist.
Wirkung auf den menschlichen Körper
Wenn das Gas aus einem Druckbehälter schnell entspannt wird, dann kann es zu Kälteverbrennungen oder Unterkühlungen auf der Haut kommen. Methan ist nicht toxisch, in hohen Konzentrationen erzeugt es aber Sauerstoffmangel beim Atmen. Die Grenze zwischen der betäubenden und der erstickenden Wirkung liegt sehr nahe beieinander.
Chemisch-physikalische Eigenschaften
Methan ist der einfachste Vertreter der Kohlenwasserstoffe und der erste Vertreter in der homologen Reihe der Alkane. Es ist in Aceton und Wasser nur wenig löslich. In Benzol, Diethylether und Ethylalkohol ist es dagegen gut löslich. Das farb- und geruchlose Gas verbrennt unter geringer Rußbildung zu Kohlenstoffdioxid und Wasser.
Methan bildet bei Volumenkonzentrationen von 5 bis 15 Prozent in Luft explosive Gemische. Die Methan-Luft-Gemische verursachen in Steinkohlebergwerken zusammen mit dem Kohlestaub die „schlagenden Wetter“, die bei Bergleuten sehr gefürchtet sind. Gemische mit reinem Sauerstoff und mit Chlor können heftig detonieren. Methan geht eine ganze Reihe weiterer chemischer Reaktionen ein, was für die industrielle Verwendung des Gases eine bedeutende Rolle spielt.
Wenn das Gas aus einem Druckbehälter schnell entspannt wird, dann kann es zu Kälteverbrennungen oder Unterkühlungen auf der Haut kommen. Methan ist nicht toxisch, in hohen Konzentrationen erzeugt es aber Sauerstoffmangel beim Atmen. Die Grenze zwischen der betäubenden und der erstickenden Wirkung liegt sehr nahe beieinander.
Chemisch-physikalische Eigenschaften
Methan ist der einfachste Vertreter der Kohlenwasserstoffe und der erste Vertreter in der homologen Reihe der Alkane. Es ist in Aceton und Wasser nur wenig löslich. In Benzol, Diethylether und Ethylalkohol ist es dagegen gut löslich. Das farb- und geruchlose Gas verbrennt unter geringer Rußbildung zu Kohlenstoffdioxid und Wasser.
CH4 + 2 O2  CO2 + 2 H2O ΔHR = −802 kJ/mol
CO2 + 2 H2O ΔHR = −802 kJ/mol
Methan bildet bei Volumenkonzentrationen von 5 bis 15 Prozent in Luft explosive Gemische. Die Methan-Luft-Gemische verursachen in Steinkohlebergwerken zusammen mit dem Kohlestaub die „schlagenden Wetter“, die bei Bergleuten sehr gefürchtet sind. Gemische mit reinem Sauerstoff und mit Chlor können heftig detonieren. Methan geht eine ganze Reihe weiterer chemischer Reaktionen ein, was für die industrielle Verwendung des Gases eine bedeutende Rolle spielt.
Im Labor ist Methan aus Aluminiumcarbid und Wasser zugänglich:
Oder man erhält es durch starkes Erhitzen eines Gemisches mit Natriumacetat und Natriumhydroxid:
In der chemischen Industrie kann Methan durch eine Reinigung von Erdgas gewonnen werden. Erdgas enthält bis zu 90 Prozent Methan. Das Gas entsteht auch in großen Mengen bei der Erdöldestillation und bei der Fischer-Tropsch-Synthese. Hierbei wird Synthesegas, ein Gemisch aus Kohlenstoffmonooxid und Wasserstoff, in einem Kontaktofen mit einem Cobaltkatalysator zu Erdölfraktionen umgesetzt, woraus das Methan abdestilliert werden kann:
Bei der bakteriellen Zersetzung organischer Stoffe wie Gras, Stalldung, Jauche und Klärschlamm entsteht vorwiegend Methan. Methanbakterien bauen die Abfallstoffe in einer biochemischen Reaktion zu Methan, Kohlenstoffdioxid, Stickstoff, Wasserstoff und Schwefelwasserstoff um, wobei Methan den Hauptanteil in diesem Biogas ausmacht. Im Fermenter einer Biogasanlage wird Methangas und Kohlenstoffdioxid durch Vergärung aus Bioabfall produziert.
Eine Kuh produziert pro Tag bis zu 20 Kilogramm Mist, daraus können etwa zwei Kubikmeter Biogas hergestellt werden. Biogas lässt sich auch aus Pflanzenabfällen gewinnen. Der so gewonnene Biogas-Treibstoff ist umweltfreundlich, es werden bei der Verbrennung nur die Mengen an Treibhausgasen erzeugt, die sonst beim Verrotten der Pflanzen entstehen würden. Nach einer Aufbereitung erhält man ein brennbares Gasgemisch mit einem Methangehalt von mehr als 97 Prozent.
Al4C3 + 12 H2O  4 Al(OH)3 + 3 CH4
4 Al(OH)3 + 3 CH4
Oder man erhält es durch starkes Erhitzen eines Gemisches mit Natriumacetat und Natriumhydroxid:
CH3-COONa + NaOH  Na2CO3 + CH4
Na2CO3 + CH4
In der chemischen Industrie kann Methan durch eine Reinigung von Erdgas gewonnen werden. Erdgas enthält bis zu 90 Prozent Methan. Das Gas entsteht auch in großen Mengen bei der Erdöldestillation und bei der Fischer-Tropsch-Synthese. Hierbei wird Synthesegas, ein Gemisch aus Kohlenstoffmonooxid und Wasserstoff, in einem Kontaktofen mit einem Cobaltkatalysator zu Erdölfraktionen umgesetzt, woraus das Methan abdestilliert werden kann:
CO + 3 H2  CH4 + H2O ΔHR = −206 kJ/mol
CH4 + H2O ΔHR = −206 kJ/mol
Bei der bakteriellen Zersetzung organischer Stoffe wie Gras, Stalldung, Jauche und Klärschlamm entsteht vorwiegend Methan. Methanbakterien bauen die Abfallstoffe in einer biochemischen Reaktion zu Methan, Kohlenstoffdioxid, Stickstoff, Wasserstoff und Schwefelwasserstoff um, wobei Methan den Hauptanteil in diesem Biogas ausmacht. Im Fermenter einer Biogasanlage wird Methangas und Kohlenstoffdioxid durch Vergärung aus Bioabfall produziert.
Eine Kuh produziert pro Tag bis zu 20 Kilogramm Mist, daraus können etwa zwei Kubikmeter Biogas hergestellt werden. Biogas lässt sich auch aus Pflanzenabfällen gewinnen. Der so gewonnene Biogas-Treibstoff ist umweltfreundlich, es werden bei der Verbrennung nur die Mengen an Treibhausgasen erzeugt, die sonst beim Verrotten der Pflanzen entstehen würden. Nach einer Aufbereitung erhält man ein brennbares Gasgemisch mit einem Methangehalt von mehr als 97 Prozent.
Methan dient zum Heizen und als Treibstoff zum Gasmotoren-Betrieb. LNG ist die Abkürzung für Liquified Natural Gas. Es handelt sich dabei um tiefgekühltes, verflüssigtes Erdgas mit einem Methangehalt von bis zu 98 Prozent. Methan wird beim Abkühlen unter −162 °C flüssig. LNG hat einen sehr hohen Brennwert, es kann in Tanks direkt beim Endverbraucher gelagert werden und wird auch in flüssiger Form transportiert. Verflüssigtes Methan benötigt nur etwa ein Sechshundertstel des Volumens im Vergleich zum gasförmigen Methan.
Methan ist auch ein wichtiger Rohstoff für Synthesen in der chemischen Industrie: Bei der Synthesegaserzeugung reagiert Methan mit Wasser bei 900 °C und dem Vorhandensein von Katalysatoren zu Kohlenstoffmonooxid und Wasserstoff. Synthesegas wird für die Ammoniaksynthese oder zur Herstellung von Methanol benötigt:
Methan kann auch zur Herstellung von Ethin verwendet werden. Bei der Pyrolyse bei 1400 °C im Lichtbogen unter Anwesenheit von Wasserdampf entsteht Ethin und Wasserstoff:
Mit Methan lassen sich in einer Chlorierung Halogenalkane wie Dichlormethan herstellen:
Auch Blausäure kann aus Methan dargestellt werden. Hierbei reagiert Methan mit Ammoniak und Luftsauerstoff am Platinkatalysator zu Cyanwasserstoff und Wasser:
Methan reagiert mit Schwefel bei 600 °C und dem Vorhandensein eines Aluminiumoxid-Katalysators zu Schwefelkohlenstoff und Schwefelwasserstoff:
Weitere Infos und Medien
Hybridorbital-Modell (beim Methan) nach Linus Pauling
Kohlenwasserstoffe als Stoffgruppe in der organischen Chemie
Energie aus Biomasse
Methan ist auch ein wichtiger Rohstoff für Synthesen in der chemischen Industrie: Bei der Synthesegaserzeugung reagiert Methan mit Wasser bei 900 °C und dem Vorhandensein von Katalysatoren zu Kohlenstoffmonooxid und Wasserstoff. Synthesegas wird für die Ammoniaksynthese oder zur Herstellung von Methanol benötigt:
CH4 + H2O  CO + 3 H2
CO + 3 H2
Methan kann auch zur Herstellung von Ethin verwendet werden. Bei der Pyrolyse bei 1400 °C im Lichtbogen unter Anwesenheit von Wasserdampf entsteht Ethin und Wasserstoff:
2 CH4  C2H2 + 3 H2
C2H2 + 3 H2
Mit Methan lassen sich in einer Chlorierung Halogenalkane wie Dichlormethan herstellen:
CH4 + 2 Cl2  CH2Cl2 + 2 HCl
CH2Cl2 + 2 HCl
Auch Blausäure kann aus Methan dargestellt werden. Hierbei reagiert Methan mit Ammoniak und Luftsauerstoff am Platinkatalysator zu Cyanwasserstoff und Wasser:
2 CH4 + 2 NH3 + 3 O2  2 HCN + 6 H2O
2 HCN + 6 H2O
Methan reagiert mit Schwefel bei 600 °C und dem Vorhandensein eines Aluminiumoxid-Katalysators zu Schwefelkohlenstoff und Schwefelwasserstoff:
CH4 + 4 S  CS2 + 2 H2S
CS2 + 2 H2S
Weitere Infos und Medien
Hybridorbital-Modell (beim Methan) nach Linus Pauling
Kohlenwasserstoffe als Stoffgruppe in der organischen Chemie
Energie aus Biomasse
© Thomas Seilnacht / Benutzerhandbuch / Lizenzbestimmungen / Impressum / Datenschutz / Literaturquellen