Demonstrationen nur für Lehrkräfte geeignet
Inhalt
Didaktische Bemerkungen Demonstration 1 Thermit-Versuch Demonstration 2 Hochofen-Modellversuch (Variante 1) Demonstration 3 Hochofen-Modellversuch (Variante 2) Ergänzende Informationen Beim Thema
Oxidation lernten die Schüler verschiedene chemische Reaktionen
kennen, bei denen Stoffe mit Sauerstoff reagierten. Bereits bei der Synthese und Analyse von Wasser (>Arbeitsblatt)
zeigte sich, dass Oxide wieder zerlegt werden können.
Metalloxide
kommen in der Natur oft als Erze vor. Die entsprechenden
Metalle können
nicht mit einfachen Methoden erhalten werden, zum Beispiel
durch einfaches Erhitzen. Es wird ein Stoff benötigt, der den Erzen
die Sauerstoff-Atome
wegnehmen kann. Daran knüpft der Einstieg in das Thema
Reduktion an.
Zum Einstieg wird ein
Stück Eisenerz und gemahlenes Eisen(III)-oxid gezeigt und die chemische
Formel dafür genannt. Der Begriff „Erz“ wird besprochen und die Schülerinnen und Schüler
sollen den Begriff in einfacher Form definieren, beispielsweise: „Erze sind Rohstoffe
für Gebrauchsmetalle“. Danach wird demonstriert, dass das Mahlen und Erhitzen von Eisenerz nicht zum gewünschten Eisen führt.
Das rote Pulver aus der Flasche färbt sich beim Erhitzen zwar dunkel,
erhält aber nach dem Abkühlen seine ursprüngliche Farbe
wieder zurück. Es lässt sich auch kein nennenswerter Magnetismus
vor und nach dem Erhitzen feststellen. Es soll dabei vernachlässigt
werden, dass Eisenerze durchaus magnetisch sein können.
Um das Prinzip der Metallgewinnung
durch Reduktion zu verdeutlichen, wird den Schülerinnen und Schülern eine fiktive
Geschichte erzählt:
„Stellt euch vor, Ihr hättet einen Schäferhund und der ist besonders verspielt. Am liebsten mag er Schuhe. Man darf also keinen Schuh herumliegen lassen, sonst fasst er ihn mit seiner Schnauze und lässt ihn nicht mehr los. Nun passiert folgendes: Ihr müsst morgens in drei Minuten an der Bushaltestelle sein und habt aufgrund der Eile nicht aufgepasst. Der Hund hat sich die Turnschuhe geschnappt, die ihr heute unbedingt in der Schule braucht. Je mehr ihr an den Schuhen zieht, umso mehr vertieft der Hund sich in sein Spiel und fasst die Schuhe nur noch fester. Was ist also zu tun? Ihr braucht die Schuhe so schnell wie möglich und möchtet euerm Hund auch keinen Schaden zufügen.“ Die Lösung wird
sicherlich genannt: Man hält dem Hund etwas hin, was er noch lieber
hat als Schuhe, zum Beispiel einen Knochen oder Hundefutter. In den meisten Fällen
wird dies auch gelingen (siehe Grafiken).
Nun überträgt man die Geschichte auf das Eisenerz: Der Hund mit
dem Schuh entspricht dem Eisenoxid. Man möchte den Schuh (das Eisen)
und gibt dem Hund (dem Sauerstoff) einen Knochen (einen Stoff, mit dem Sauerstoff
noch besser reagiert als mit Eisen). Aufgrund schon durchgeführter
Experimente im vorangegangenen Unterricht kennen die Schüler vielleicht
solche Stoffe und benennen sie: Magnesium, Aluminium oder Wasserstoff.
Nun wird ein Reaktionsschema an der Tafel hergeleitet:
Eisenoxid +
Aluminium
Über das zweite
Reaktionsprodukt dürfen die Schüler spekulieren. Manche nennen
vielleicht schon das Aluminiumoxid („Hund mit Knochen“). Nun wird der eigentliche
Thermit-Versuch vorbereitet. Es sind diese Sicherheitsvorkehrungen unbedingt einzuhalten:
Fertigmischung: Alternativ dazu kann der Tontopf mit einer käuflichen Fertigmischung gefüllt werden. Das Loch am Boden wird vor dem Füllen durch eine Lage Papier verdeckt. Zur Sicherheit kann der Tontopf noch in einen zweiten Tontopf gestellt werden. Die Tontöpfe werden an einem Stativring in etwa 30 Zentimeter Höhe über dem Boden befestigt. 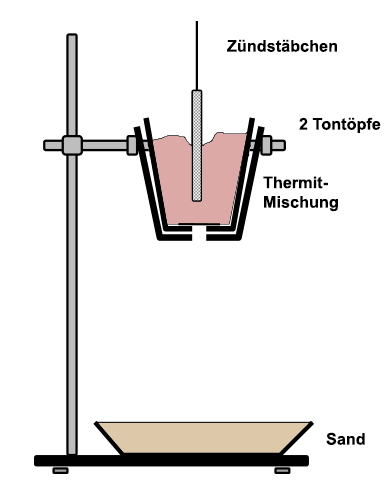
Nun begibt
man sich an
einen geeigneten Ort im Freien und sorgt für einen
Sicherheitsabstand
von 10 Metern für die Zuschauer. Unter den Tontopf wird
eine Ton-Schale gestellt, die mit reichlich Sand gefüllt ist.
Eigene Mischung: In die Mischung steckt man eine Wunderkerze und gibt in eine Vertiefung darum herum einen Spatel-Löffel Magnesiumpulver dazu. Damit das Gemisch sicher zündet, könnte man noch einen Spatel-Löffel Kaliumpermanganat unter das Magnesiumpulver geben. Allerdings besteht hierbei die Gefahr, dass sich die Zündmischung durch Reibung vorzeitig entzündet. Kopf unbedingt fernhalten! Die Zündkomponenten dürfen erst, nachdem die Wunderkerze bereits hineingesteckt ist, direkt vor der Zündung und unvermischt nacheinander ohne Reibung auf das Thermit gelegt werden. Fertigmischung: Bei der Verwendung eines im Handel erhältlichen Zündstäbchens ist keine zusätzliche Zündmischung notwendig. Nach dem Zünden des Zündstäbchens am äußersten Ende mit einer Lötlampe bei weit ausgestrecktem Arm ist eine rasche Entfernung geboten. Beobachtungen: Nach dem Hineinbrennen des Zündstäbchens
glüht das Thermit-Gemisch unter heftiger Funkenbildung hell auf. Dann
ergießt sich ein glühender, flüssiger Strahl durch die Löcher der Tontöpfe in die Schale.
Dabei fliegen Funken weit umher. Nach der Reaktion findet sich ein schwerer,
teilweise metallisch glänzender Brocken auf dem Sand, der immer noch
glüht und so heiß ist, dass er selbst ein feuchtes Holzstöckchen
rasch zum Brennen bringt.
Nach dem Abkühlen
des Produkts in kaltem Wasser wird es näher untersucht. Schlägt
man mit einem Hammer darauf, platzt die äußere Schicht des Brockens
schnell ab. Teilweise zeigen sich auch weißliche Schichten (Hinweis
auf Aluminiumoxid). Innen findet sich eine kompakte, metallische Masse,
die einen deutlichen Magnetismus zeigt (Hinweis auf Eisen). Durch stärkere Schläge
lässt sich jedoch auch diese Masse zerschlagen. Das entstandene Roheisen
ist relativ spröde.
Theorie: Die theoretische Erklärung für diesen Versuch kann nun von den Lernenden selbst hergeleitet werden: Eisenoxid reagiert mit Aluminium zu Roheisen und Aluminiumoxid. Damit ist das Prinzip einer Stoffumsetzung erarbeitet (>chemische Reaktion). Bei einer Stoffumsetzung werden Atome oder Atomgruppen ausgetauscht. Die Reaktion eines Stoffes mit einem anderen unter Sauerstoff-Abgabe nennt man Reduktion. Findet wie im geschilderten Beispiel gleichzeitig eine Reduktion (Eisenoxid) und eine Oxidation (Aluminium) statt, handelt es sich um eine Redox-Reaktion: Zu diesem Zeitpunkt wird
vorerst nur der einfache Oxidationsbegriff zurückgehend auf Lavoisier
vorausgesetzt.
Die Thermit-Reaktion dient in der Technik aufgrund der hohen, entstehenden
Temperatur bis 2400 °C zum schnellen Verschweißen von großen
Eisenstücken, zum Beispiel zum schnellen Verbinden von Bahngleisen beim Thermitschweißen.
Entsorgung: Die Reste werden im Abfallbehälter für anorganische Feststoffe gesammelt. Es wird generell empfohlen, Abfälle für Feststoffe in einem brandsicheren Behälter mit Deckel und Sandeinlage zu sammeln. Sicherheit: Es dürfen nur Verbrennungsrohre aus Quarzglas eingesetzt werden. Das Einsetzen der Quarzwolle und das Erhitzen erfolgt stets im Abzug. Es muss eine Schutzbrille angezogen werden, Schutzhandschuhe aus Leder sollten bereitliegen! Beim Einsetzen der Quarzwolle sollte eine Staubschutzmaske getragen werden.
Zunächst wird mit den Schülerinnen und Schülern die Wirtschaftlichkeit des Thermit-Verfahrens zur Eisengewinnung diskutiert. Jährlich werden weltweit über 500 Millionen Tonnen Roheisen hergestellt. Beim Thermit-Verfahren würden riesige Mengen an metallischem Aluminium benötigt. Aluminium kann ebenfalls nur unter hohem Energieaufwand durch Schmelzflusselektrolyse aus Aluminiumerzen hergestellt werden. Außerdem würde die Thermit-Reaktion bei einem industriellen Verfahren zu viel Wärme freisetzen. Für eine billigere, geregelte Reaktion eignen sich Kohlenstoff oder Wasserstoff als Reduktionsmittel. Das bedeutendste Verfahren findet im Hochofen mit Hilfe von Koks statt, einem Zersetzungsprodukt der Stein- oder Braunkohle. Die Apparatur wird gemäß
der Zeichnung aufgebaut. Zur Isolierung nach unten und oben muss unbedingt
Glaswolle aus Quarzglas verwendet werden, da gewöhnliche Glaswolle
bei den hohen Temperaturen schmilzt. Außerdem müssen die Büschel
ohne Spielraum satt sitzen. In der Mitte werden zwei Doppelschichten aus
jeweils zwei Zentimeter hoch gekörnter Aktivkohle und ein Zentimeter Eisen(III)-oxid fest fixiert.
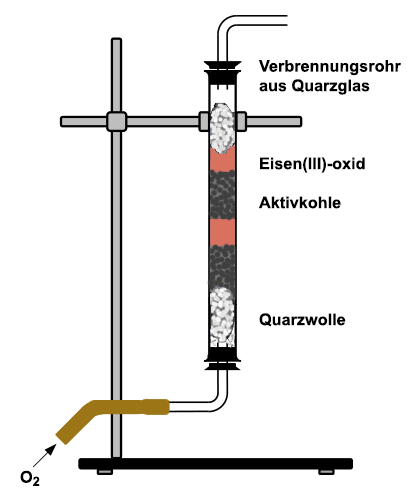
Die unterste Schicht
Aktivkohle wird mit einem Brenner und einer Lötlampe von beiden Seiten
kräftig erhitzt. Dann gibt man einen schwachen Sauerstoff-Strom durch
das Verbrennungsrohr und wartet ab, bis die Aktivkohle zu glühen beginnt.
Nun erhitzt man das Eisen(III)-oxid und stellt den Sauerstoff-Strom so ein,
dass die Glut-Zone nicht zu heiß wird. Der Vorgang dauert mehrere
Minuten, wobei man später auch die oberen Schichten erhitzt. Nach
dem Abkühlen gibt man das Gemisch in eine Porzellanschale und untersucht
es mit einem Magneten.
Beobachtungen: Bei der Sauerstoff-Zugabe glüht die Kohle hell auf. Dabei entstehen beträchtliche Temperaturen, die möglicherweise auch das Quarzglas springen lassen. Das Reaktionsprodukt ist deutlich magnetisch. Theorie: Im Verbrennungsrohr laufen verschiedene Reaktionen ab, die den Hochofenreaktionen entsprechen. Beim Verbrennen der Kohle mit Sauerstoff in der unteren Schicht entsteht Kohlenstoffmonooxid, das das darüber liegende Eisen(III)-oxid zu Eisen reduziert und selbst zu Kohlenstoffdioxid oxidiert wird. Das neu entstehende Kohlenstoffmonooxid reduziert dann wieder erneut Eisenoxid zu Eisen. In der Apparatur wird das Kohlenstoffmonooxid zum Kohlenstoffdioxid vollständig umgesetzt. Die Reaktionen entsprechen dem Hochofenprozess. Entsorgung: Die Reste werden im Abfallbehälter für anorganische Feststoffe gesammelt. Es wird generell empfohlen, Abfälle für Feststoffe in einem brandsicheren Behälter mit Deckel und Sandeinlage zu sammeln. Demonstration
3 Hochofen-Modellversuch
(Variante 2)
Diese Variante ist aufgrund des entstehenden Kohlenstoffmonooxids für Schulen nicht geeignet! Sicherheit: Die
Büchse benötigt einen sicheren Stand. Der Versuch darf nur im
Freien oder in einem gut ziehenden Abzug durchgeführt werden. Schutzbrille anziehen und Schutzhandschuhe aus Leder bereitlegen! Es entstehen
größere Mengen toxisches Kohlenstoffmonooxid!
Dieses Gas darf auf gar keinen Fall eingeatmet werden. Es ist darauf zu
achten, dass es laufend abgefackelt wird.
Die
Variante im Reagenzglas
hat den Nachteil, dass man nur wenig magnetisches Eisen
erhält. Steht
Pressluft oder ein Gebläse zur Verfügung,
lässt sich ein
Hochofenmodell in einer gewöhnlichen
Weißblechbüchse bauen.
Etwa drei Zentimeter über dem Büchsenboden wird
ein Loch in die Seitenwand
gebohrt. Durch dieses Loch wird ein Eisen- oder Stahlrohr
(Innendurchmesser etwa 0,5 Zentimeter) eingeführt, das am Ende
zusammengedrückt ist, so dass
die eingeführte Pressluft breit gestreut wird. Die Dose
wird innen
mit feuchtem Ton ausgekleidet. Der verbleibende Innenraum
sollte etwa 5 Zentimeter
breit und 10 Zentimeter hoch sein. Nun füllt man die
Büchse mit zerkleinerter
Holzkohle in Erbsengröße. Danach richtet man eine
Lötlampe auf
das seitliche Loch, während das Eisenrohr noch nicht
eingesetzt ist
und erhitzt die Kohle, bis sie um das Loch herum
kräftig glüht.
Dann wird die Pressluft über das aufgesetzte Eisenrohr
zugeführt
und der seitliche Schlitz mit zusätzlichem Ton
abgedichtet. Durch
Regulieren der Luftzufuhr wird die ganze Kohle in der
Büchse zum Glühen
gebracht. Das Aufheizen erfolgt 20 bis 30 Minuten lang,
dabei wird mehrmals
Kohle nachgefüllt. Das bei der Verbrennung entstehende
Kohlenstoffmonooxid
wird oben an der offenen Büchse abgefackelt. Dass
hierbei dieses Gas
entsteht, erkennt man an der rosa-violetten Flamme:
Dann gibt man als erste
Portion 20 Gramm Eisen(III)-oxid auf die glühende Holzkohle, die
sogleich mit einer frischen Kohle-Schicht bedeckt wird. Sobald die oberste
Kohle-Schicht glüht, wird der Vorgang des Beschichtens wiederholt.
Nach dem Einfüllen der letzten Schicht, erhitzt man den Ofen durch
Zugeben mit Pressluft noch etwa 20 Minuten lang. Nach dem Abkühlen
finden sich in der Schlacke sichtbare Mengen metallisches Roheisen.
Entsorgung: Die Reste werden im Abfallbehälter für anorganische Feststoffe gesammelt. Es wird generell empfohlen, Abfälle für Feststoffe in einem brandsicheren Behälter mit Deckel und Sandeinlage zu sammeln. Hinweis: Dieser Versuch wurde von der Studentengruppe C. Casparis, T. Gauch und M. Medici an der PH Luzern getestet und modifiziert. Die Gruppe baute auch den abgebildeten Modellofen. Eine leicht abgewandelte Beschreibung findet sich im Buch von Jürgen Reiß, Alltagschemie im Unterricht, erschienen im Aulis-Verlag. |