Als Waschmittel
bezeichnet man allgemein waschaktive Substanzen, die in der Lage
sind Textilien zu reinigen. Moderne Waschmittel enthalten eine ganze Reihe
verschiedener Inhalts- und Wirkstoffe, sie sind vor allem auf die Anforderungen
einer Trommelwaschmaschine abgestimmt. Im Gegensatz zu früher werden
auch höhere Anforderungen an Textilien, ihre Sauberkeit und den Tragekomfort
gestellt. Die Werbung propagiert „weiße Wäsche“, Grauschleier
sind verpönt. Während früher eher robuste Gewebe zum Einsatz
kamen, verwendet man heute eine Vielzahl an veredelten Textilien. Vollwaschmittel
sind für die meisten Textilien und Waschverfahren im Temperaturbereich
von 30 bis 95 °C geeignet. Buntwaschmittel
eignen sich für die Wäsche von farbigen Textilien bis zu einer
Temperatur von 60 °C. Feinwaschmittel sind
besonders schonend, sie eignen sich für die Handwäsche oder bis
30 °C. Sie enthalten keine optische Aufheller
und keine Bleichmittel, dafür mehr Enzyme
und einen höheren Seifengehalt. Spezialwaschmittel
sind für Wolle, Seide oder spezielle Stofffasern erhältlich.
Besonders umweltschonend
sind Waschmittel nach dem Baukastensystem. Betrachtet man die Dosierungsanleitung
eines normalen Vollwaschmittels, dann wird umso mehr Waschmittel in die
Trommel gegeben, je höher die Wasserhärte des verfügbaren
Wassers ist. In Gegenden mit hoher Wasserhärte
werden daher bestimmte Inhaltsstoffe des Vollwaschmittels überdosiert.
Ein Baukastenwaschmittel enthält ein
Basiswaschmittel, dem je nach Bedarf mehr Enthärter bei hoher Wasserhärte oder mehr Bleichmittel bei farbigen Verschmutzungen zugegeben wird.
Vollwaschmittel sind
im Handel pulverförmig, flüssig, gelförmig oder in Tab-Form
erhältlich. Die genauen Rezepturen sind ein gut gehütetes Geheimnis.
Der Grundaufbau – bestehend aus Tensiden, Enthärter, Bleichmittel
und weiteren Inhaltsstoffen ist jedoch in allen Vollwaschmitteln ähnlich.
Flüssige und gelförmige Vollwaschmittel enthalten in der Regel
keine Bleichmittel. Die Kompaktwaschmittel
in Tab-Form sind im Vergleich zu den pulverförmigen Waschmitteln umweltfreundlicher,
da sie weniger Füllstoffe und eine optimale Kombination an effektiven
Wirkstoffen enthalten.
1. Tenside
Die Tenside
in den Waschmitteln lösen den Schmutz von Textilien ab oder
verhindern die Wiedereinlagerung auf der Textilfaser. Für den Chemiker
ist ein Tensid (von lat. tensio, Spannung) eine Substanz, die die
Grenzflächenspannung
zwischen zwei Phasen herabsetzen kann. Tenside ermöglichen das Vermischen
von zwei normalerweise nicht mischbaren Flüssigkeiten wie Öl
und Wasser und sie besitzen das Vermögen, Schaum auszubilden. Die
traditionell hergestellte Seife kann ebenfalls
zu den Tensiden gezählt werden. Allerdings werden an die heutigen,
modernen Tenside viel höhere Ansprüche gestellt. Tenside sind
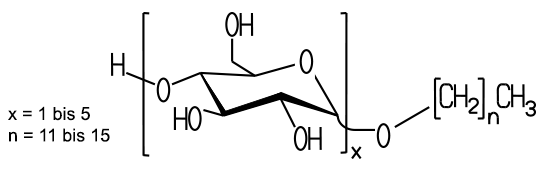
allgemein aus einem hydrophoben und einem hydrophilen Teil aufgebaut. Der
polare, hydrophile Teil besteht je nach Tensid aus unterschiedlichen Anteilen,
der hydrophobe Teil ist meist aus langen Kohlenstoffketten aufgebaut (>Grafik).
Moderne Vollwaschmittel enthalten immer eine Kombination von mehreren Tensiden,
beispielsweise eine Kombination von LAS und FAEO,
sowie ein geringer Anteil Seife.
Bei den anionischen
Tensiden ist die hydrophobe Alkylgruppe mit einem negativ geladenen
Carboxylat- (-COO−), einem Sulfonat- (-SO3−)
oder einem Sulfat-Ion (-O-SO3−) verbunden. Die traditionell
hergestellte Seife gehört zum ersten Vertreter
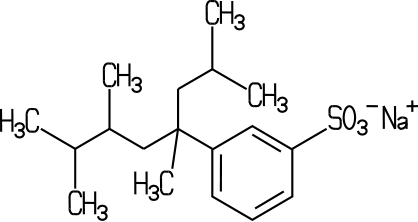
dieser Tensidart. Die Alkylbenzolsulfonate sind wirtschaftlich jedoch am
bedeutendsten. Das preisgünstig herzustellende, im Molekülbau
stark verzweigte Tetrapropylenbenzolsulfonat (TPS) war nach dem Zweiten Weltkrieg
bis Mitte der 1960er Jahre das am häufigsten eingesetzte Tensid
überhaupt. Die Komponenten dafür waren aus Erdöl als Rohstoff
zugänglich. Die schlechte biologische
Abbaubarkeit und das Entstehen von Schaumbergen in Flüssen und Seen
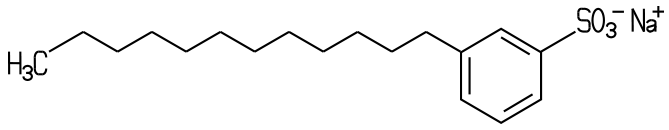
führte jedoch zur Entwicklung der besser abbaubaren, linearen Alkylbenzolsulfonate
(LAS) (>Herstellung). Zu der Gruppe
der anionischen Tenside gehören auch die Alkansulfonate (SAS), die
Fettalkoholsulfate (FAS) und die Fettalkoholethersulfate (FAES). Die FAS
(>Herstellung) können aus pflanzlichen
Rohstoffen wie Rapsöl oder Kokosöl hergestellt werden.
| Verzweigtes und lineares Alkylbenzolsulfonat | |||
| |||
| Die linearen Alkylbenzolsulfonate (LAS) wie Dodecylbenzolsulfonat sind biologisch besser abbaubar. |
Bei den kationischen
Tensiden ist der hydrophile Anteil durch eine positiv geladene,
stickstoffhaltige Gruppe vertreten. Als Gegenladung
wirkt ein Chlorid-Ion Cl− oder ein Methylsulfat-Ion CH3OSO3−
Diese Tenside sind besonders in Weichspülern enthalten, da sie wie
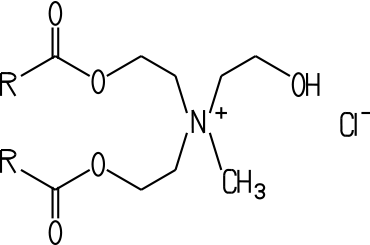
ein Gleitmittel wirken. Zu den kationischen Tensiden gehören die sogenannten
Esterquats:
Nichtionische
Tenside oder Niotenside bilden in wässriger
Lösung keine Ionen. Die nichtionischen Tenside zeigen einige
Vorteile:
Sie sind absolut unempfindlich gegen Wasserhärte, sie zeigen auch
bei
niedrigen Konzentrationen und Temperaturen ein gute Waschwirkung, sie
schäumen nur wenig, und sie wirken gleichzeitig als
Vergrauungsinhibitoren. Die Saponine
aus dem Seifenkraut oder aus den
Waschnüssen gehören ebenfalls
in die Gruppe der Niotenside. Die industriell
bedeutendste Stoffgruppe dieser Tenside sind die Fettalkoholethoxylate
(FAEO):
Die Alkylpolyglucoside
(APG) auf Zuckerbasis lassen sich aus nachwachsenden Rohstoffen wie Mais,
Zuckerrohr und Kokosnüssen gewinnen
(>Herstellung). Sie weisen daher eine günstige
Ökobilanz auf, außerdem sind sie hautverträglich und biologisch
gut abbaubar.
Amphotere
Tenside enthalten eine negative und eine positive Gruppe im hydrophilen
Teil. Ein bekannter Vertreter hierzu ist das Betain-Tensid, das in Shampoos
und Geschirrspülmitteln gelegentlich eingesetzt wird. Auch diese Tenside sind unempfindlich gegen
hartes Wasser und gut hautverträglich.
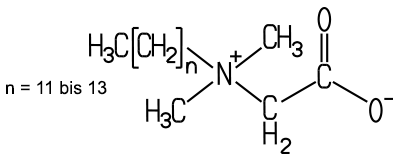
Betain-Tensid ist ein Vertreter der amphoteren Betaine
2. Enthärter (Gerüststoffe)
Die Wasserhärte
hängt von der Konzentration der Härtebildner wie die im Wasser
enthaltenen Calcium- oder Magnesium-Ionen ab. Die Calcium-Ionen Ca2+ entstehen in kalkhaltigem Wasser im Carbonat-Gleichgewicht.
Sie bilden mit Seifen schwerlösliche Salze, die als weißer Niederschlag
aus dem Wasser ausfällen.
Durch die Reaktion der Ionen mit der Seife wird beim Waschvorgang erheblich mehr Seife benötigt. Das ist ein entscheidender Nachteil. Außerdem lagert sich die dabei entstehende Kalkseife auf dem Textilgewebe ab und macht dieses im Lauf der Zeit „hart“ und brüchig. Die Wäsche vergraut, auch die Saugfähigkeit wird deutlich vermindert. Bei höheren Temperaturen verkalken zudem die Heizstäbe der Waschmaschine durch Kesselsteinbildung.
2R-COO− + Ca2+  (R-COO)2Ca
(R-COO)2Ca
Durch die Reaktion der Ionen mit der Seife wird beim Waschvorgang erheblich mehr Seife benötigt. Das ist ein entscheidender Nachteil. Außerdem lagert sich die dabei entstehende Kalkseife auf dem Textilgewebe ab und macht dieses im Lauf der Zeit „hart“ und brüchig. Die Wäsche vergraut, auch die Saugfähigkeit wird deutlich vermindert. Bei höheren Temperaturen verkalken zudem die Heizstäbe der Waschmaschine durch Kesselsteinbildung.
Die Wasserhärte schwankt
stark je nach Gegend. In kalkhaltigen Gebirgen, beispielsweise im Jura
oder auf der Schwäbischen Alb hat man es meist mit sehr hartem Wasser
zu tun. Die Härtebereiche sind nach den Deutschen Härtegraden unterteilt:
|
Härte- bereich |
Dt. Härtegrade °dH |
Gesamthärte mmol/l |
Bezeichnung |
| 1 | 0 bis 7 | 0,0 bis 0,7 | weich |
| 2 | 7 bis 14 | 0,7 bis 1,4 | mittel |
| 3 | 14 bis 21 | 1,4 bis 2,1 | hart |
| 4 | > 21 | > 2,1 | sehr hart |
Ein Wasserenthärter
vermag es, die härtebildenden Ionen aus dem Wasser zu entfernen. Da
den Enthärtern heute noch andere Aufgabe zukommen – beispielsweise
die Verbesserung der Tensid-Eigenschaften – spricht man heute auch von Gerüststoffen.
Die ersten Vollwaschmittel enthielten Soda als Enthärter.
Dadurch reagierten die Calcium-Ionen zu Calciumcarbonat oder Calciumsilicat,
ohne dass dabei Seife verbraucht wurde. Das Verkalken der Fasern konnte
man dadurch jedoch nicht verhindern.
Ab den 1930er-Jahren
setzte man Phosphate als Enthärter
ein. Das Pentanatriumtriphosphat bildet im Wasser sogenannte Chelatkomplexe,
die Calcium-Ionen an sich binden können. Dabei entsteht aus einem Triphosphat-Anion
mit einem Calcium-Ion ein Calcium-Triphosphat-Komplex:
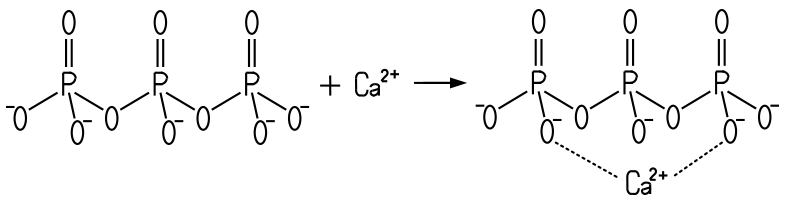
Bildung eines Calcium-Triphosphat-Komplexes
Die
Phosphate verursachten durch die hohe Nährstoffzufuhr ein verstärktes
Algenwachstum und eine starke Eutrophierung
der Gewässer. Daher führte man in den Industrieländern ab
den 1980er-Jahren eine neue Gruppe an Enthärtern in den Waschmitteln
ein. Die Zeolithe stellen eine Stoffgruppe
dar, die aus wasserhaltigen Calcium- oder Natriumaluminiumsilicaten aufgebaut
sind. In der Natur kommen sie in zahlreichen Mineralien wie im Heulandit
oder im Stilbit vor. Normalerweise
sind die Zeolithe nicht wasserlöslich. Durch das Herstellen von Zeolithen
mit sehr kleiner Korngröße erhält man das Zeolith A, das
unter dem Markennamen Sasil® bekannt ist. Aufgrund ihrer
Gitterstruktur halten die Zeolithe Calcium- und Magnesium-Ionen fest. Dabei
werden diese durch Ionenaustausch im Kristallgitter des Zeoliths eingebunden. Der Phosphat-Verbrauch ist heute zurückgegangen.
In einigen Spezialwaschmitteln, beispielsweise in Klarspülern werden
sie noch eingesetzt.
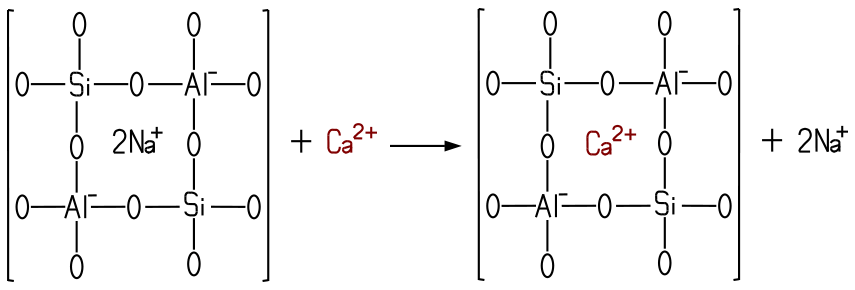
Bindung der Calcium-Ionen durch Ionenaustausch im Sasil®.
3. Bleichmittel
Manche farbige Verschmutzungen
wie Rotwein- oder Kaffeeflecken sind sehr hartnäckig und lassen sich
durch das Behandeln mit einem Tensid nicht entfernen. Früher legte
man die Wäsche nach dem Waschen zum Bleichen in die UV-Strahlung der
Sonne. Heute erfolgt das Bleichen in Vollwaschmitteln durch Stoffe, die
Sauerstoff freigeben und die Farbstoffe
durch Oxidation zerstören. Gleichzeitig
werden Bakterien abgetötet. Natriumperoxoborat setzt Wasserstoffperoxid
frei, sobald es in Wasser gelöst wird. Vor allem bei höheren
Temperaturen ab 60 °C zerfällt das Wasserstoffperoxid zu Wasser
und Sauerstoff (>Arbeitsblatt). Die Bleichwirkung hängt auch vom
pH-Wert ab. Eine optimale Wirkung
erreicht man bei pH=10 bis 11. Das reprotoxische Natriumperoxoborat wird in modernen Waschmitteln zunehmend durch Natriumpercarbonat ersetzt.
In manchen Ländern
wie in den USA, in Japan oder in Südeuropa werden Bleichmittel auf
Chlorbasis wie das Natriumhypochlorit
(NaOCl) eingesetzt. Dies findet vor allem dann statt, wenn bei niedrigen
Temperaturen gebleicht werden soll. Die chlorhaltige Bleichlauge ist jedoch
problematisch, da sie mit Abwasser zu möglicherweise krebserzeugenden
Organochlorverbindungen (AOX) reagieren kann. Durch zugesetzte Bleichaktivatoren
kann man jedoch auch bei niedrigen Temperaturen mit Bleichmittel auf Sauerstoffbasis
bleichen. Das hierfür geeignete Tetraacetylethylendiamin (TAED) bildet
mit dem Wasserstoffperoxid eine neue
Verbindung, die ein noch stärkeres Oxidationsmittel darstellt.
4. Enzyme
Eiweiß- oder stärkehaltige
Verschmutzungen von Eigelb, Soßen oder Blut lassen sich durch Tenside
und Bleichmittel nicht entfernen, besonders dann wenn sie angetrocknet
sind. Zum Reinigen dafür sind besondere Wirkstoffe notwendig. Die
Enzyme bestehen aus großen, kompliziert
aufgebauten Eiweißmolekülen, sie selbst wirken als Biokatalysator
und spalten große Molekülteile in kleinere auf. Je nach Wirkungsbereich
bezeichnet man die Enzyme als Proteasen (Eiweiß spaltende Enzyme),
als Amylasen (Stärke spaltende Enzyme), als Lipasen (Fett spaltende
Enzyme) oder als Cellulasen (Cellulose spaltende Enzyme). Die Proteasen
spalten beispielsweise langkettige, wasserunlösliche Eiweiße
in kurzkettige, wasserlösliche Bruchstücke wie Aminosäuren
oder Peptide auf. Da sie als Biokatalysator wirken, werden sie dabei selbst
nicht verbraucht.
Seit 1960 können
Enzyme im industriellen Umfang aus Bakterien gewonnen werden. Der Einsatz
von Enzymen in Waschmitteln führte aufgrund der Einatmung von feinem
Enzymstaub in den 1960er Jahren zu allergischen Erkrankungen. Daher kapselte
man die Enzyme in kleine Kügelchen ein, den Enzym-Prills.
Manche Enzyme wie die Lipasen werden heute durch gentechnische Verfahren
hergestellt.
5. Optische Aufheller, Weißtöner
Weiße Leinen- oder
Baumwollwäsche erscheint in einem leichten Gelbstich. Das rührt
daher, dass die Wäsche bevorzugt kurzwelliges Licht absorbiert. Dem
reflektierten Licht fehlt daher der Blauanteil und das menschliche Auge
nimmt die Komplementärfarbe
der Absorption von Blau als Gelb wahr. Die Werbeindustrie vermittelte lange
Zeit die Vorstellung, dass weiße Wäsche nach dem Motto „weißer als weiß“ besonders hygienisch
und sauber sei. Früher verwendete
man in Waschmitteln geringe Mengen des Pigments Ultramarinblau oder „Wäscheblau“, um einen Blaustich zu erzeugen. Dadurch verstärkte
man den Weißeindruck. Heute werden kompliziert gebaute, organische
Verbindungen als optische Aufheller verwendet,
die ultraviolettes Licht absorbieren können und dafür
blaues Licht aussenden. Die Wäsche erscheint in einem Blaustich, den
wir als besonders reines Weiß wahrnehmen. Unter einer UV-Lampe wird
dieser Blaustich noch in besonderem Maße verstärkt:
6. Vergrauungsinhibitoren
Die Verwendung von Tensiden
verhindert noch nicht, dass der Schmutz nach dem Ablösen wieder auf
die Textilfaser aufzieht. Die Vergrauungsinhibitoren heften sich an die
Faser und verhindern das Wiederansetzen des Schmutzes. So ist ein gutes
Schmutztragevermögen gewährleistet. Es werden Cellulosederivate
wie Carboxymethylcellulose eingesetzt.
7. Verfärbungsinhibitoren
Wäscht man ein rotes
T-Shirt zusammen mit weißer Wäsche in einer Waschmaschine, kann
sie die weiße Wäsche verfärben. Das eingesetzte Polvinylpyrrolidon
(PVP) verhindert das Wiederaufziehen eines bereits abgelösten Farbstoffes.
Es findet daher bevorzugt in Buntwaschmitteln seine Anwendung.
8. Stabilisatoren
In manchen Gegenden enthält
das Wasser Eisen-, Kupfer- oder Mangan-Ionen. Manche Waschmittel enthalten
auch Spuren von Schwermetallsalzen. Diese zersetzen schon beim Lagern katalytisch
die Bleichmittel wie Wasserstoffperoxid. Die dafür eingesetzten Komplexbildner
wie die heute eingesetzten Phosphonate wie ATMP adsorbieren die Schwermetall-Ionen
und heben dadurch deren katalytische Wirkung auf.
9. Schauminhibitoren
Das Entstehen von Schaum
zeigt zwar an, dass das Wasser relativ weich ist, allerdings stellt Schaum
keine Voraussetzung für die Wirksamkeit beim Waschvorgang dar. Zuviel
Schaum bremst sogar den Vorgang, da die mechanische Bewegung in der Waschtrommel
behindert wird. Die Zugabe von herkömmlicher Seife reguliert den Schaum,
da sie beim Vorhandensein von Calcium-Ionen von Wasser im mittleren Härtebereich
Kalkseife bildet. In ganz weichem Wasser wirkt dann die Seife allerdings
nicht mehr als Schauminhibitor. Daher werden auch spezielle Siliconöle
oder Paraffinöle eingesetzt.
10. Sonstige Inhaltsstoffe
Korrosionsinhibitoren
verhindern die Zersetzung von aluminiumhaltigen Bauteilen durch die Waschlauge
bei den Waschmaschinen. Obwohl praktisch alle heutigen Waschmaschinen Edelstahltrommeln
besitzen, wird aus Sicherheitsgründen heute noch Wasserglas (Natriummetasilicat,
Na2SiO3) zugesetzt. Riechstoffe
unterdrücken den unangenehmen Duft der Waschlauge und verleihen der
Wäsche einen angenehmen Duft. Allerdings reagieren einige Personen
allergisch auf sensibilisierende Riechstoffe, daher sind auch unparfümierte Waschmittel
erhältlich. Farbstoffe
sollen das Waschmittelprodukt für den Verbraucher attraktiv machen,
ihnen kommt für den Waschvorgang keinerlei Bedeutung zu. Füllstoffe
wie das Natriumsulfat in pulverförmigen
Waschmitteln erhöhen die Rieselfähigkeit und ermöglichen
eine gute Dosierbarkeit. Früher gaukelten sie dem Verbraucher mehr
Inhalt in der Packung vor. Heute bevorzugen die Verbraucher jedoch eher
platzsparende Waschmittel wie die Tabs. Als
Konservierungsstoffe werden Stoffe eingesetzt wie sie für Kosmetika
zulässig sind, sie ermöglichen eine lange Lagerfähigkeit.