|
Lebenslauf
Justus von Liebig kam schon früh mit der Chemie in Berührung. Sein Vater betrieb ein kleines Geschäft mit einem Labor, in dem er Farben und Lacke herstellte. Nach einer erfolglosen Schulkariere und dem Abbruch einer Apothekerlehre konnte Liebig ab 1819 Chemie in Bonn bei dem Chemiker Karl Wilhelm Gottlob Kastner (1783-1857) studieren. Als sein Lehrer nach Erlangen berufen wurde zog Liebig ebenfalls dorthin. Kastner war es auch, der ihm später mit Hilfe eines Stipendiums das Studium an der Pariser Universität Sorbonne ermöglichte. In Paris dozierten Größen wie Joseph Louis Gay-Lussac (1778-1850), Louis-Jacques Thenard (1777-1857) oder Nicolas Louis Vauqelin (1763-1829). Bei ihnen lernte Liebig das exakte, wissenschaftliche Arbeiten. In dieser Zeit entstand auch eine erste Arbeit über das Knallquecksilber (Quecksilberfulminat). Im Jahre 1824 wurde Liebig außerordentlicher Professor für Chemie und Pharmazie an der Universität Gießen. Die darauf folgenden 28 Jahre in Gießen waren für Liebig relativ anstrengend, da die finanziellen Mittel zunächst begrenzt waren. Trotzdem arbeitete Liebig Tag und Nacht in seinem Labor - sehr zum Leidwesen eines Angestellten, der am Abend die Laborgeräte reinigen sollte. Allmählich wurde er durch seine Arbeiten in ganz Europa bekannt. Durch die Freundschaft mit Friedrich Wöhler entstand ein reger Austausch. Liebig lehnte zahlreiche Berufungen an andere Universitäten ab, bis er im Jahre 1852 aufgrund eines verlockenden Angebotes durch den König Maximilian I. von Bayern nach München ging. Der Bayernkönig sicherte ihm den Bau eines neuen chemischen Instituts und ein angrenzendes Wohnhaus zu. In München lebte Liebig bis zu seinem Tod durch eine Lungenentzündung im Jahre 1873. Theorien und Werk Neben seinen herausragenden wissenschaftlichen Errungenschaften ist es vor allem Justus von Liebig zuzuschreiben, dass die Chemie didaktisch unterrichtet wurde und junge Chemiker dadurch eine gezielte Ausbildung erhielten. R. Winderlich schrieb beispielsweise in "Das Buch der grossen Chemiker": "Als Liebig sein Studium begann, war ihm keine Möglichkeit bekannt, auf deutschem Boden die wissenschaftliche Laboratoriumsarbeit zu erlernen, (...) so wanderte Liebig nach Paris. (...) Weder Berzelius, noch Gay-Lussac, noch Davy, noch sonst einer der großen Chemiker jener Zeit befaßte sich damit, geeignete junge Leute zu Chemikern planmäßig heranzubilden. (...) Sie hielten Vorlesungen, aber sie unterrichteten nicht. (...) Es ist vielleicht die bedeutendste Tat Liebigs, daß er diesem Zustand ein Ende gemacht hat, daß er eine echte Schule der Chemie gegründet hat." (R. Winderlich in G. Bugge: Das Buch der grossen Chemiker, Zwickau 1929, Nachdruck 1955, S. 23) In Paris ermittelte Liebig zusammen mit Joseph Louis Gay-Lussac auf dem experimentellen Weg die Zusammensetzung des Silberfulminats. Es ist ein stark explosives Silbersalz der Knallsäure mit der Formel AgONC. Friedrich Wöhler hatte dagegen für das Silbercyanat (AgOCN), einem Salz der Cyansäure, die gleiche Formel ermittelt. Durch umfangreiche Analysen fanden die beiden Chemiker schließlich heraus, dass die beiden Stoffe zwar aus den gleichen Aufbausteinen aufgebaut waren, sich aber in ihren chemischen Eigenschaften unterschieden und daher vermutlich einen anderen, inneren Aufbau hatten. Berzelius prägte dafür den Begriff der Isomerie. Die Knallsäure ist mit der Cyansäure isomer. Die Salze der Knallsäure zerfallen oberhalb von 190°C explosionsartig mit einem hellen Lichtblitz (lat. fulmen, Blitz). Die Cyanate sind dagegen weitgehend stabil. Trotz großer Anstrengungen war es anderen Chemikern wie Lavoisier, Gay-Lussac oder Berzelius bis dahin noch nicht gelungen, eine zuverlässige und wenig zeitraubende Methode für die quantitative Analyse von organischen Stoffen zu entwickeln. Im Jahre 1831 veröffentlichte Liebig die Arbeit "Über einen neuen Apparat zur Analyse organischer Körper und über die Zusammensetzung einiger organischer Substanzen". Der Apparat bestand in einer wesentlichen Verbesserung eines Gerätes von Berzelius. Das bei der Verbrennung aus den organisch gebundenen Wasserstoffatomen gebildete Wasser ließ Berzelius durch getrocknetes Calciumchlorid aufsaugen, das gebildete Kohlenstoffdioxid leitete er in festes Kaliumhydroxid ein. Durch wägen der Gewichtszunahmen konnte er das Verhältnis der Verbrennungsprodukte bestimmten und damit die Zusammensetzung des in einem Verbrennungsrohr verbrannten Kohlenwasserstoffs ermitteln. Nach diesem Prinzip werden heute noch Elementaranalysen durchgeführt. Liebig entwickelte einen "Kaliapparat", er verbesserte den Kohleofen durch eine Dreiteilung und verjüngte die Spitze des Verbrennungsrohres bajonettförmig. Durch die Dreiteilung des Kohleofens konnte er das Verbrennungsrohr gezielt mit Teilen von glühender Holzkohle umgeben und damit die Geschwindigkeit regeln. Nach der Verbrennung wurde die Spitze am Verbrennungsrohr abgebrochen. Der Kaliapparat (auch "Fünf-Kugel-Apparat") ermöglichte die schnelle und zuverlässige Absorption von großen Kohlenstoffdioxidmengen: 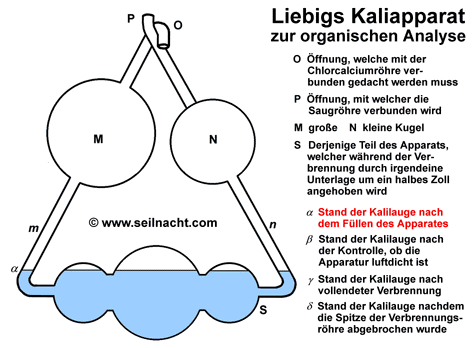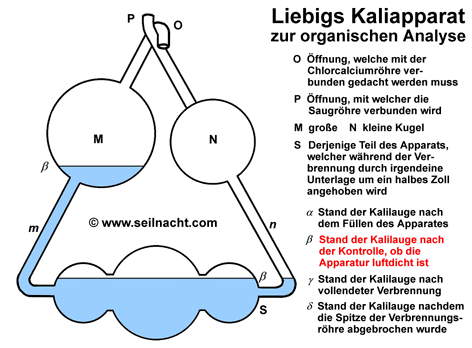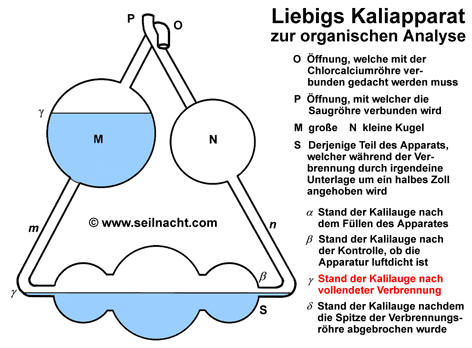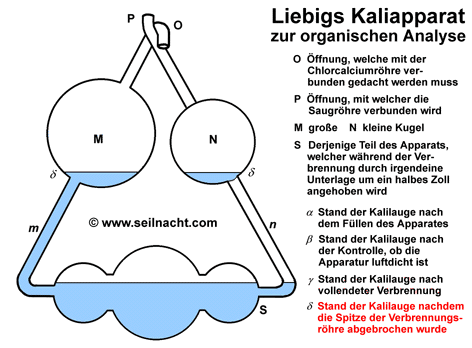 Das bei der Verbrennung entstehende Kohlenstoffdioxid wird im Kaliapparat in konzentrierte Kalilauge geleitet. Dabei bildet sich Kaliumcarbonat: 2 KOH + CO2 Die Zunahme der Masse kann mit einer Waage gewogen werden. Mit Hilfe des Kaliapparates kann der Kohlenstoffgehalt von Proben einfach bestimmt werden. Der Apparat von Liebig war ein wichtiger Beitrag in der Entwicklung der Elementaranalyse. Die Bestimmung des Stickstoff nahm Liebig mit einer anderen Apparatur - unabhängig von der Kohlenstoffbestimmung - vor. In der Folgezeit untersuchte er zusammen mit seinen Schülern zahlreiche Substanzen wie die Alkaloide (u.a. Atropin) und erstellte deren Summenformeln. Bei diesen Arbeiten entdeckte er auch das Chloroform und die Gruppe der Aldehyde. In enger Zusammenarbeit mit Berzelius und Wöhler wurden die Summenformeln von Benzoesäure und ihren Derivaten aufgestellt. Diese Arbeiten begründeten die Systematik der organischen Chemie und der Zuordnung von funktionellen Gruppen. Die funktionellen Gruppen, also die Wiederkehr bestimmter Atomgruppierungen nannten sie zunächst "Radikale" und entwickelten eine sogenannte "Radikaltheorie" (Der Begriff "Radikale" ist heute nur noch in der Bedeutung von "freien Radikalen" gebräuchlich. Damit bezeichnet man Molekülbruchstücke, bei denen nicht alle Elektronen gepaart vorliegen). In der Folgezeit stellte Liebig eine neue
Säure-Base-Theorie auf. Berzelius vertrat
wie Lavoisier die Theorie, dass Säuren wasserbindende Oxide seien
und mit Basen unter Wasserabscheidung Salze bildeten. So sollte sich ein
neutrales Salz aus einem "Atomgewicht" Base mit einem "Atomgewicht" Säure
bilden. Diese Meinung widerlegte Liebig und führte dabei die Phosphorsäure
und einige andere organische Säuren als Gegenbeispiel an. Diese Säuren
lieferten jeweils zwei oder drei Gruppen von Salzen. Dabei erkannte er
die Bedeutung der Wasserstoffatome in den Säuren, ohne jedoch die
genauen Zusammenhänge (wie die der Protonenübergänge) zu
kennen.
|