| Nitrate | |||||||
Die Nitrate sind die Salze
der Salpetersäure. Sie enthalten das Nitrat-Anion NO3−. Nitrate kommen in den Böden immer
in einer bestimmten Konzentration vor. Bei
der Versorgung der Pflanzen mit Nährsalzen spielen sie eine bedeutende Rolle.
Aus den Stickstoff-Atomen der Nitrate bauen die Pflanzen Eiweiße,
die für alle Pflanzenfresser lebensnotwendig sind. Bei der Verwesung
der toten Lebewesen entstehen in einem Fäulnisprozess Ammoniak
und Ammoniumsalze. Diese werden durch eine Nitrifikation bestimmter Bodenbakterien
wieder zu Nitratsalzen umgewandelt. Bei der Nitrifikation entstehen als
Zwischenprodukt auch Nitrit-Ionen.
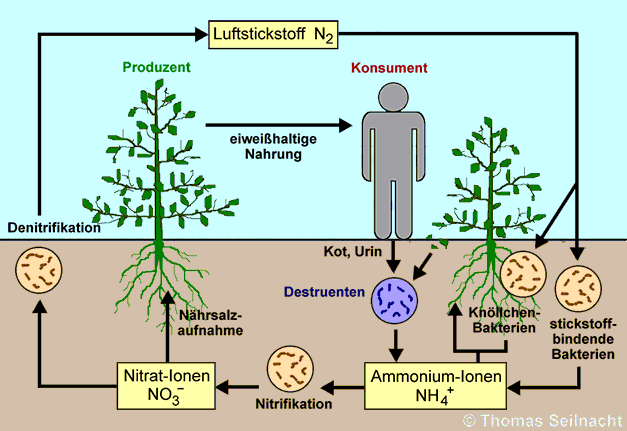 Von großer Bedeutung sind auch die Knöllchenbakterien, welche aus dem Luftstickstoff Ammonium-Ionen bilden können und damit die Nährsalzaufnahme der Pflanzen unterstützen. Andere Bodenbakterien erzeugen durch eine Denitrifikation wieder Stickstoff, der an die Atmosphäre abgegeben wird. Alle stickstoffhaltigen Salze wie Ammoniumnitrat oder Kaliumnitrat eignen sich zur Herstellung von Düngemitteln. Kaliumnitrat dient zur Herstellung von Schießpulver, auch Natriumnitrat war früher ein wichtiger Rohstoff dafür. Die großflächige Ausbringung von Nitratdünger kann zu einer gesundheitlichen Gefährdung führen, wenn im gedüngten Gemüse oder im Trinkwasser zu viel Nitrat enthalten ist. Hohe Nitratgehalte weisen Spinat, Kopfsalat und manchmal auch Kartoffeln auf. Gemüse aus biologischem Anbau enthält in der Regel weniger Nitrat. Wenn Säuglingen über Nahrung zu viel Nitrat zugeführt wird, besteht die Gefahr einer akuten Vergiftung. Deshalb sollten Säuglinge keine nitratbelasteten Gemüse wie Spinat oder Kopfsalat erhalten. Gemüse sollte nur aus Babynahrung verabreicht werden. Beim Säugling ist die Magensäureproduktion noch nicht voll ausreichend. Dadurch können sich im Magen des Säuglings Nitrat-Salze zu toxischen Nitrit-Salzen umwandeln. Nitrite wie Natriumnitrit stören den Sauerstofftransport im Blut. Die akute Vergiftung, die Blausucht, äußert sich in Kopfschmerzen, Schwindel, flacher Atmung und einer Blauverfärbung der Haut und der Lippen. Diese Zeitungsmeldung verdeutlicht die Gefahren: "Das Basler Kantonslaboratorium
warnt vor der Verwendung von nitratreichem Gemüse als Säuglingsnahrung.
In Basel musste ein acht Monate altes Baby deswegen ins Spital. Die Ärzte
diagnostizierten bei dem Säugling eine Blausucht, d.h. eine lebensgefährliche
Unterversorgung mit Sauerstoff, wie das Kantonslabor mitteilte. Dem Baby
war eine selbst zubereitete Säuglingskost mit Kohlrabi verabreicht
worden." (Pressemeldung 10.09.2003) Nitrate besitzen aber
auch eine gefährliche Langzeitwirkung: Im Speichel des Erwachsenen
werden regelmäßig kleine Mengen Nitrate in Nitrite umgewandelt.
Diese Nitrite können mit den Aminen im Magen zu Nitrosaminen reagieren: Nitrosamine sind sehr gefährlich: Sie können schon in geringsten Mengen Krebs erzeugen. Die Weltgesundheitsorganisation (WHO) empfiehlt deshalb, nicht mehr als 220 mg ( = 0,22 g) Nitrat täglich zu sich zu nehmen. Ein Liter Trinkwasser darf nach der deutschen Trinkwasserverordnung höchstens 50 mg Nitrat enthalten, in Österreich gilt der gleiche Grenzwert, in der Schweiz liegt er bei 40 mg. Dies kann aber für Säuglinge bereits gefährlich sein. Deshalb sollten sie nur nitratarmes Mineralwasser erhalten. Einigen Wurst- oder Käsesorten wird Nitrat oder sogar Nitrit als Lebensmittel-Zusatzstoff zur Konservierung zugesetzt: Chemische Eigenschaften der Nitrate Alle Nitrate sind gut
wasserlöslich und spalten beim Erhitzen Sauerstoff
ab. Sie eignen sich aufgrund dieser Eigenschaft als gute Oxidationsmittel.
Kaliumnitrat ist zum Beispiel ein Bestandteil des Schwarzpulvers, das in
der Feuerwerkerei und als Schießpulver eingesetzt wird. Die
Alkali-Nitrate wandeln sich beim Erhitzen unter Sauerstoffabgabe in
die entsprechenden Nitrite um. Beim Erhitzen von Kaliumnitrat
KNO3 erhält man Kaliumnitrit KNO2
und Sauerstoff:
2 KNO3 Die anderen Nitrate zerfallen beim Erhitzen in die entsprechenden Oxide, in Stickstoffdioxid und in Sauerstoff. Erhitzt man Blei(II)-nitrat, werden rotbraune, giftige Dämpfe von Stickstoffdioxid frei: 2 Pb(NO3)2 Herstellen der Nitrate Nitrate lassen sich durch
das Auflösen von Metallen oder Metalloxiden in konzentrierter Salpetersäure
herstellen. Diese Reaktionen verlaufen teilweise sehr heftig und gleichzeitig
werden toxische Gase freigesetzt. Bei der Reaktion von Kupfer
mit Salpetersäure entsteht Kupfer(II)-nitrat:
3 Cu + 8 HNO3 Das dabei gebildete Gas Stickstoffmonooxid NO reagiert sofort mit der Luft weiter zu Stickstoffdioxid. Chemischer Nachweis der Nitrate Der Nitrat-Nachweis im Labor erfolgt mit Lunges Reagenz. Diese besteht aus zwei Lösungen, die getrennt aufbewahrt werden. Reagenz 1 ist eine 1%ige Lösung von Sulfanilsäure in 30%iger Essigsäure und Reagenz 2 eine konzentrierte Lösung von 1-Napthylamin in 30%iger Essigsäure. Zum Nachweis eines Nitrats gibt man auf eine Tüpfelplatte eine kleine Menge der Stoffprobe und säuert sie mit verdünnter Salzsäure an. Danach gibt man je einen Tropfen von Reagenz 1 und 2 hinzu und versetzt die Mischung mit einigen Milligramm Zinkstaub. Eine langsam sich bildende Rotfärbung zeigt die Existenz von Nitrat-Ionen an. Bei der Reaktion wird das Nitrat durch das Zink zu Nitrit reduziert, und in Reaktion mit den Reagenzien bildet sich ein roter Azofarbstoff. Erklärung der Reaktion Weitere Informationen Düngemittel Eutrophierung eines Gewässers Explosivstoffe Salpetersäure Buch individuell erstellen: Basis-Text Nitrate  
> Inhaltsverzeichnis |