
|
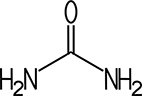
Farblose Kristalle Vorkommen Produkt des Eiweiß-Stoffwechsels im Harn |
Molmasse
60,055 g/mol
AGW 10 mg/m3 E (einatembare Fraktion für Stäube allgemein) Dichte 1,3230 g/cm3 Schmelzpunkt +132,4 °C zersetzt sich bei weiterem Erhitzen Wasserlöslichkeit Konz. bei 20 °C 1000 g/l |
| - | - | Entsorgung Hausmüll, Abwasser |
| Etikett drucken | Dt. Bezeichnung
Synonyme (deutsch) |
Engl. Bezeichnung
Synonyme (engl.) |
| CAS 57-13-6 | Harnstoff
Diaminomethanal Kohlensäurediamid |
Urea
Diaminomethanal Carbamide |
| Eigenschaften
Harnstoff bildet farb-
und geruchlose Kristalle. Aus einer wässrigen Lösung kristallisiert
er in langen, prismatischen Nadeln nach dem tetragonalen
Kristallsystem aus. In Chloroform und Ether ist Harnstoff nicht löslich.
In Methanol, Ethanol und Glycerin löst er sich gut. Durch das Erhitzen in
einer sauren oder alkalischen Lösung wird Harnstoff in Kohlenstoffdioxid
und Ammoniak gespalten:
H2N-CO-NH2 + H2O Die Aminogruppe NH2
im Harnstoff reagiert mit den Aldehyden
unter Zugabe von konzentrierter Salzsäure in einer Polykondensation.
Auf diese Art und Weise lassen sich die hitzebeständigen Aminoplaste
wie Harnstoff-Formaldehyd (UF-Harz) herstellen.
Harnstoff wird durch das Enzym Urease in Kohlenstoffdioxid und Ammoniak gespalten. Die Urease aus den Bodenbakterien ermöglicht die Spaltung des Harnstoffs in der Gülle. Ohne dieses Enzym wäre eine Düngung mit tierischen Exkrementen nicht möglich. Bei der Reaktion im Boden bilden sich Ammonium-Ionen, die für den Stickstoffkreislauf von Bedeutung sind. Ein Teil geht als Ammoniakgas in die Luft verloren. Diese eher unerwünschte Reaktion passiert vor allem in Jauchegruben oder am Stallboden.
|
| Herstellung
Harnstoff ist eine wichtiges
Endprodukt des menschlichen und tierischen Stoffwechsels von Stickstoff-Verbindungen.
Im Harn scheidet der Mensch täglich etwa 20 bis 30 Gramm Harnstoff aus. Der
Harnstoff entsteht in der Leber im Harnstoff-Zyklus. Dabei reagiert Ammoniak
mit Kohlenstoffdioxid in einer relativ komplizierten Reaktion zu Harnstoff.
Der Vorgang dient zum Abbau von Ammoniak im Stoffwechsel
und ermöglicht gleichzeitig die Herstellung der lebensnotwendigen
Eiweiß-Bausteine L-Arginin und
L-Ornithin.
Friedrich Wöhler (1800–1882) Der Harnstoff wurde bereits im Jahr 1729 von dem holländischen Professor für Medizin und Chemie Hermann Boerhaave (1668–1738) im Urin entdeckt. Er stellte aus dem Urin erstmals kristallinen Harnstoff her. Der Pariser Chemiker Guillaume-Francois Rouelle (1703–1770) führte diesen Versuch im Jahr 1773 erneut durch. Die erste Synthese und damit auch die Aufklärung der atomaren Zusammensetzung gelang jedoch erst dem deutschen Chemiker Friedrich Wöhler. Wöhler erhielt den Harnstoff im Jahr 1828 durch das Eindampfen einer wässrigen Lösung aus Ammoniumcyanat. Mit dieser Synthese – und auch mit der von ihm im Jahr 1824 vorangegangenen Synthese der Oxalsäure – widerlegte Wöhler die damals verbreitete Meinung, dass organische Stoffe grundsätzlich nur von Lebewesen hergestellt werden können. 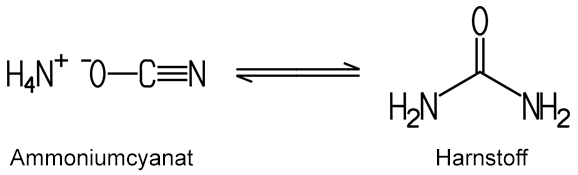
Die industrielle Herstellung
des Harnstoffs erfolgt heute hauptsächlich aus Ammoniak
und Kohlenstoffdioxid. Dabei entsteht als
Zwischenprodukt
Ammoniumcarbamat, das bei hohem Druck von bis zu 40 bar und einem
dreifachen Ammoniak-Überschuss in Harnstoff übergeht:
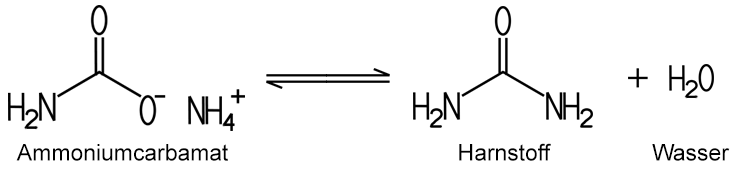 |
| Verwendung
Harnstoff ist aufgrund seines hohen Stickstoffgehaltes ein wichtiges Düngemittel und Futtermittel. In der chemischen Industrie dient er zur Herstellung
von Aminoplasten und Melamin, in der Medizin zur Synthese des Schlafmittels Carbromal. Die Harnstoff-Kristalle
bilden käfigartige Gitterstrukturen, in die andere Stoffe eingeschlossen
werden können, daher eignet sich Harnstoff zur Abtrennung von Paraffinen
aus einem Kohlenwasserstoff-Gemisch, da
die Paraffine in die Harnstoff-Kristalle eingeschlossen werden.
Moderne Dieselfahrzeuge enthalten einen kleinen Zusatztank, in dem sich eine klare Flüssigkeit befindet, die unter dem Handelsnamen AdBlue erhältlich ist. Benutzt wird eine 32,5 %ige Lösung von Harnstoff in destilliertem Wasser. Im SCR-Katalysator entsteht aus dem Harnstoff das Gas Ammoniak, das die Stickoxide in Stickstoff und Wasserdampf umwandelt. In der Schule wird der Harnstoff gerne verwendet, um Enzymreaktionen mit dem Enzym Urease aufzuzeigen. Es kann mit den Experimenten auch die Abhängigkeit der Reaktionsgeschwindigkeit von der Temperatur nachgewiesen werden |