|
Lebenslauf
Linus Pauling wurde als Sohn eines Apothekers in einer armen Familie geboren. Die Eltern waren aus Freiburg im Breisgau in die USA eingewandert. Als Kind beobachtete er, wie sein Vater Mixturen zubereitete. Der Vater Herman Henry William Pauling starb, als Linus Pauling neun Jahre alt war. Das Interesse an der Chemie wurde bei dem 13-jährigen Linus während der Schulzeit durch einen Schulfreund geweckt, der ein Chemielabor im Schlafzimmer hatte. Nach seinem Studium am Oregon State Agricultural College in Corvallis (heute Orgeon State University) wechselte er an das California Institute of Technology (CalTech) in Pasadena. Dort schrieb er seine Doktorarbeit über die Kristallstrukturen von Mineralien. 1925, nach der Promotion, erhielt Linus Pauling ein Stipendium und ging für eineinhalb Jahre nach Europa. Den größten Zeitanteil verbrachte er in München bei Arnold Sommerfeld (1868–1951), der 1919 das Bohrsche Atommodell weiterentwickelt hatte. Der Europaaufenthalt führte ihn auch nach Zürich zu Erwin Schrödinger (1867–1961) und nach Kopenhagen zu Niels Bohr. Ab 1927 war Pauling Assistenz-Professor am Caltech in Kalifornien, ab 1930 mit einer vollwertigen Professur, und ab 1936 Direktor an den Crellin Laboratories of Chemistry. In dieser Zeit – bis zum Zweiten Weltkrieg – widmete sich Pauling ganz der Forschung und entwickelte seine berühmten Theorien über die chemische Bindung. Im zweiten Weltkrieg arbeitete Pauling in der militärischen Forschung. Nach dem ersten Einsatz der ersten Atombombe bildete sich 1946 bei den Wissenschaftlern in den USA unter der Führung von Albert Einstein eine Gruppe, die vor einer nuklearen Katastrophe warnte. Linus Pauling sammelte Unterschriften für die nukleare Abrüstung. Bei den Politikern des Kalten Krieges fand er damit jedoch nur wenig Gehör. In der Ära um den amerikanischen Hardliner Joseph McCarthy galt Pauling zeitweise sogar als „Verdächtiger“ oder als „Kommunist“ und man verweigerte ihm die Teilnahme an Veranstaltungen im Ausland. Unbeeindruckt davon verlieh ihm das schwedische Nobelpreiskomitée 1954 den Nobelpreis Chemie für seine Forschungen über die Natur der chemischen Bindungen. 1958 übergab Pauling eine Petition gegen Kernwaffentestversuche mit 11000 Unterschriften von führenden Wissenschaftlern und Fachexperten dem UN-Generalsektretär. Einen Teststopp konnte die Gruppe zunächst nicht erreichen, dafür wurde die Weltöffentlichkeit für das Problem sensibilisiert. 1963 unterschrieben der amerikanische Präsident J. F. Kennedy und der russische Präsident Nikita Chruschtschow ein Moratorium, das zukünftige Atomtests nur noch unterirdisch erlaubte. Die Aktivitäten der Gruppe unter der Leitung von Linus Pauling und das 1958 von ihm erschienene Buch „No More War!“ wurde im Jahr 1962 mit dem Friedensnobelpreis für Linus Pauling geehrt. Ein Jahr später verließ Pauling das Caltech und ging an das Center for the Study of Democratic in Santa Barbara. Sein politisches Engagement gab Pauling nicht mehr auf, später engagierte er sich gegen den Vietnamkrieg und gegen die Stationierung von Mittelstreckenraketen. In den späten Jahren propagierte Linus Pauling die gesundheitsförderne Wirkung von hohen Dosen an Vitamin C, was allerdings auch sehr umstritten war. Pauling glaubte, ein Vorsorgemittel gegen Krebs gefunden zu haben. 1974 gründete er mit anderen Wissenschaftlern das Institute of Science and Medicine (heute Linus-Pauling-Institut) in Palo Alto, Kalifornien. Linus Pauling wurde 93 Jahre alt, er starb an Krebs. Theorien und Werk Zu der Zeit, als Linus Pauling seine Doktorarbeit schrieb, kam gerade die Kristallstrukturanalyse mit Hilfe von Röntgenstrahlen auf. Durch Beugungs- und Interferenzeffekte an den Elektronen der Gitteratome von Kristallen werden Muster auf eine photographische Platte abgebildet. Die Promotionsarbeit Paulings befasste sich mit der Röntgenstrukturanalyse anorganischer Verbindungen und war eine der frühsten Arbeiten auf diesem Gebiet überhaupt. 1916 hatte G.N. Lewis (1875–1946) die kovalente Bindung (heute auch: Elektronenpaarbindung oder Atombindung) beschrieben. Nach diesem Wissenschaftler ist die heutige Lewis-Schreibweise benannt und seine Arbeiten zogen Pauling in besonderem Maße an. Während seiner fruchtbaren Arbeitsphase als Professor am Caltech ermittelte Pauling Bindungslängen und -winkel und verknüpfte die Daten mit der Wellenmechanik von Erwin Schrödinger (1887–1961). Ein Kernbegriff der Quantenmechanik ist der Begriff der Resonanz. In seinem berühmten Buch (* siehe >Anmerkung) beschrieb er die Vorstellung so: „Die Vorstellung von der Resonanz basiert auf einem Fundamentsatz der Quantenmechanik, der bei fast allen chemischen Problemen eine Rolle spielt, die etwas mit dem Grundzustand der Moleküle zu tun haben (...) Mitunder erscheinen zwei Strukturen dem Grundzustand eines Systems angemessen. Würde man auf der Forderung bestehen, dass ein System durch eine einzige Strukturformel wiederzugeben ist, dann stünde man vor der Frage, für welche der beiden Strukturen man sich entscheiden sollte. Die Frage wäre jedoch falsch gestellt. Es handelt sich in einem solchen Fall nicht um die Entscheidung zwischen der einen oder der anderen Struktur, sondern um eine geeignete Kombination beider Strukturen.“ (Pauling, S. 9.) In Deutschland ist der Begriff Resonanz eher unter dem Begriff "Mesomerie" bekannt (Näheres siehe >Benzol). Werner Heisenberg (1901–1976) entwickelte als erster die Vorstellung von Resonanz an Heliumatomen. Pauling wandte sie auf die chemische Bindung an und konnte zeigen, dass der Austausch von Elektronen bei chemischen Bindungen eine entscheidende Rolle spielt. Pauling führte auch den Begriff der Hybridisierung ein. Nach dem Schalenmodell besitzt ein Kohlenstoffatom in der äußeren Schale 2 Elektronen im 2s-Orbital und 2 Elektronen im 2p-Orbital. Demnach müsste es im Methan eigentlich zwei unterschiedliche Bindungen zwischen dem Kohlenstoff-Atom und den vier Wasserstoff-Atomen geben. Nach Paulings Untersuchungen und Berechnungen ließen sich die vier C-H-Bindungen jedoch nicht unterscheiden. Die Lösung zur Erklärung des Problems beschrieb Pauling in der Ausbildung von vier gleichartigen sp3-Hybridorbitalen, die mit je einem Elektron besetzt sind. „Die vier Bindungen des Kohlenstoffs sind gleichartig und nach den vier Ecken eines regulären Tetraeders gerichtet“ (Pauling, S. 111). Die vier gleichwertigen und relativ stabilen C-H-Bindungen im Methan bezeichnete Pauling als σ-Bindungen (Sigma-Bindungen). Für die vier tetraedrisch orientierten Bindungen ermittelte Pauling einen Winkel von 109° und 28 Minuten. Er errechnete auch die Bindungswinkel vieler anderer Moleküle. Aufgrund des Modells lassen sich aus dem Molekülbau Vorhersagen über die Eigenschaften der Stoffe machen. Beispielsweise lässt sich die Reaktionsfreudigkeit des Ethylens dadurch erklären, dass im sp2-Hybridorbitalmodell die π-Bindung (Pi-Bindung) in der Doppelbindung instabiler als die σ-Bindung ist. Dadurch geht die Doppelbindung leicht auf und der Stoff ist offen für neue Reaktionspartner. Auf Pauling geht auch die erste Skala mit einer Gegenüberstellung der Elektronegativität für verschiedene Atome zurück. „Die Bezeichnung Elektronegativität wurde von den Chemikern eingeführt, um qualitativ zum Ausdruck zu bringen, mit welcher Stärke ein Atom in einem Molekül Elektronen an sich zieht.“ (Pauling, S. 84) Die von Pauling im Jahre 1932 aufgestellte Elektronegativitätsskala zeigt Gesetzmäßigkeiten im Periodensystem auf und sie gibt eine grobe Orientierung, welche Bindungsarten zwischen den Atomen entstehen (siehe >Elektronegativität). Pauling beschrieb auch die Wasserstoff-Brückenbindung. Er erkannte die Bedeutung dieser Bindungsart, die zwischen den Molekülen als schwache Bindung wirkt, aber beispielsweise beim Wasser erheblich die chemisch-physikalischen Stoffeigenschaften mitbestimmt (siehe bei >Ethylalkohol). Die zwischen den Molekülen wirkenden Van-der-Waalsschen Kräfte beeinflussen die Siede- und Schmelztemperatur der Stoffe. "Mit abnehmendem Molekulargewicht nehmen die Van-der-Waalsschen Kräfte und damit auch die Schmelz- und Siedetemperaturen ab." (Pauling, S. 427). So lässt sich erklären, warum in der homologen Reihe der Alkohole die Schmelz- und Siedetemperaturen mit zunehmender Kettenlänge der Alkohole steigen. Mit Hilfe seiner Theorien über chemische Bindungen konnten zahlreiche Strukturen bei den kompliziert aufgebauten biochemischen Verbindungen verständlich gemacht werden. Seit Mitte der 1930iger Jahre beschäftigte sich Pauling mit dem Blutfarbstoff Hämoglobin, das zu den Eiweißen gehört. Die Beschäftigung mit den Proteinen führte ihn zu einer Idee, wie die Aminosäuren sich zu Polypeptidketten anordnen könnten: „Die Polypetid-Ketten der Protein-Moleküle sind in ganz bestimmter Weise gebunden. Für die Atomanordnungen in ihnen spielen die N-H...O-Wasserstoff-Brücken eine wichtige Rolle (...) Zwei schraubenartige Anordnungen der Polypeptid-Ketten erfüllen (...) die Bedingungen größter Stabilität der Amid-Gruppen und der N-H...O-Bindungen. Eine davon, die sogenannte α-Helix, ist eine ziemlich große Schraube, mit einem Hohlraum entlang der Achse.“ (Pauling, S. 463 und 464) 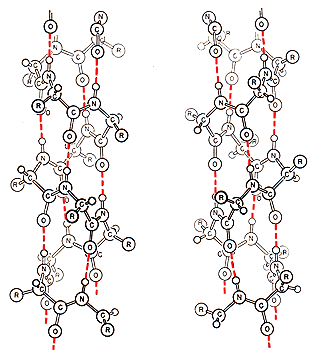 Pauling versuchte, diese Erkenntnisse auf die Strukturaufklärung der Desoxyribonucleinsäure (DNS, international auch DNA) anzuwenden. Hier kamen ihm 1953 aber James Watson (1928–2025) und Francis Crick (1916–2004) zuvor. Mit ihrem Wendeltreppenmodell der Doppelhelix hatten sie die Struktur der Erbsubstanz DNS gefunden. Möglicherweise entging Pauling diese Entdeckung, weil er in der McCarthy-Ära nicht aus den USA ausreisen durfte und teilweise keinen Zugang zu ausländischen Forschungsergebnissen hatte. Pauling ging von einer Dreifachhelix aus und musste sich aber am Ende geschlagen geben. 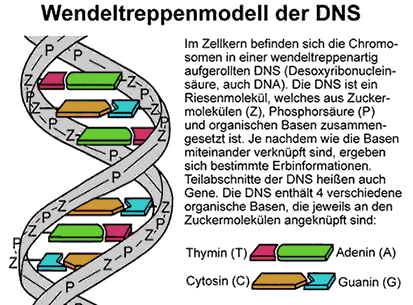 Paulings Entdeckung der α-Helix bei den Proteinen leitete auf dem Gebiet der Biochemie eine Revolution aus, die bis heute im Bereich der Genforschung anhält. Die Ergebnisse seiner Arbeiten zur chemischen Bindung sind heute praktisch in jedem Lehrbuch der Chemie zu finden. Pauling und seine Frau wurden von einem dem Autor persönlich bekannten Kollegen als sehr sympatisch beschrieben. Vor allem sein Engagement für die Verantwortung der Wissenschaft erzeugte eine nachhaltige Wirkung bei den nachkommenden Generationen. *) Anmerkung Wie Pauling mit Hilfe der komplizierten Wellenfunktionen der Quantenmechanik rechnete, soll hier nicht aufgezeigt werden, das würde den Leser überfordern. Stattdessen werden ein paar auf ihn zurückgehende Begriffe aus seinem Hauptwerk vorgestellt, die heute in den Schulen allgemein gebräuchlich sind. Die verwendeten Zitate sind alle aus der deutschen Ausgabe von 1968 Die Natur der chemischen Bindung entnommen. Diese Ausgabe war die 3. deutsche Auflage und ist mehrfach korrigiert worden. Die englische Erstausgabe erschien schon 1939 unter dem Titel The Nature of the Chemical Bond and the Structure of Molecules and Crystals. Ein Vorläufer zu diesem Buch war das 1931 erschienene Buch The Nature of the Chemical Bond. Auf die zahlreichen anderen Arbeiten von Linus Pauling wird hier bei den Zitaten nicht eingegangen. Erwähnenswert wäre noch das Lehrbuch: Grundlagen der Chemie (dt. Erstauflage Weinheim 1956). Empfehlenswerte Literaturquellen
|