Wenn man eine Substanz
erhitzt und diese mit rußender Flamme verbrennt oder verkohlt, ist
Kohlenstoff nachgewiesen. In beiden Fällen
entsteht elementarer Kohlenstoff. Erhitzt man einen organischen Stoff wie
Holz oder ein Polymer in einem Reagenzglas, verkohlen diese. Stoffe mit
einem hohen Kohlenstoff-Anteil wie Benzol
rußen kräftig beim Verbrennen. Als Schulversuch eignet sich
das Erhitzen von Zucker auf einem Verbrennungslöffel.
Ruß
Verkohlung
Bei einer Verkohlung wird der organische Stoff vollständig zersetzt, wobei reiner Kohlenstoff übrig bleibt. Auf ähnliche Art und Weise entstanden bei der Zersetzung von totem Pflanzenmaterial durch anaerobe Bakterien im Laufe der Jahrmillionen die Kohle-Lagerstätten.
Indirekter Kohlenstoff-Nachweis
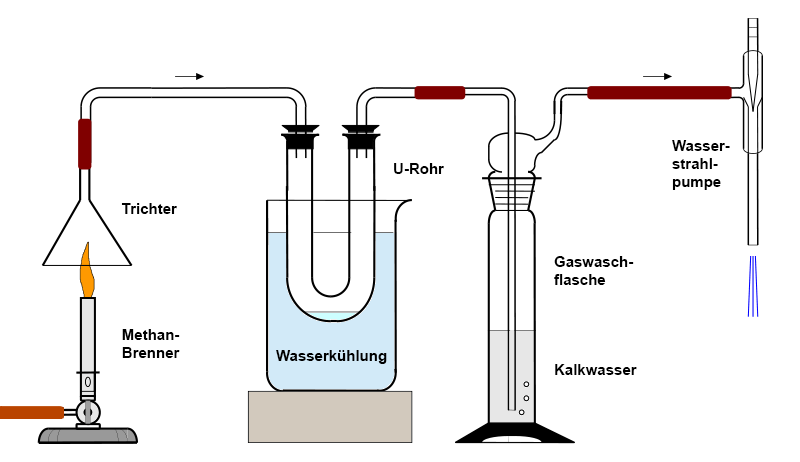
Für einen indirekten Kohlenstoff-Nachweis verbrennt man die Substanz und saugt die Verbrennungsgase mit Hilfe einer Wasserstrahlpumpe durch eine Gaswaschflasche mit Kalkwasser. Eine Trübung des Kalkwassers weist Kohlenstoffdioxid nach. Es entsteht durch Oxidation der Kohlenstoff-Atome bei der Verbrennung von Methan-Gas. Im gekühlten U-Rohr kondensiert als weiteres Verbrennungsprodukt Wasser. Dies ist ein indirekter Wasserstoff-Nachweis.
Kohlenstoffhaltiger Ruß
entsteht in der Regel bei unvollständigen Verbrennungen, zum Beispiel wenn
Dieselkraftstoff in schlecht eingestellten Motoren verbrannt wird. Die
Rußpartikel sind 5 bis 500 Nanometer groß. Sie enthalten je nach Herstellungsweg
neben dem Kohlenstoff auch Wasserstoff, Schwefel, Stickstoff oder Sauerstoff.
Organische Stoffe rußen bei der Verbrennung umso mehr, je höher
das Verhältnis der Kohlenstoff-Atome zu den restlichen Atomen ist.
Bei einer Verkohlung wird der organische Stoff vollständig zersetzt, wobei reiner Kohlenstoff übrig bleibt. Auf ähnliche Art und Weise entstanden bei der Zersetzung von totem Pflanzenmaterial durch anaerobe Bakterien im Laufe der Jahrmillionen die Kohle-Lagerstätten.
Indirekter Kohlenstoff-Nachweis
Für einen indirekten Kohlenstoff-Nachweis verbrennt man die Substanz und saugt die Verbrennungsgase mit Hilfe einer Wasserstrahlpumpe durch eine Gaswaschflasche mit Kalkwasser. Eine Trübung des Kalkwassers weist Kohlenstoffdioxid nach. Es entsteht durch Oxidation der Kohlenstoff-Atome bei der Verbrennung von Methan-Gas. Im gekühlten U-Rohr kondensiert als weiteres Verbrennungsprodukt Wasser. Dies ist ein indirekter Wasserstoff-Nachweis.
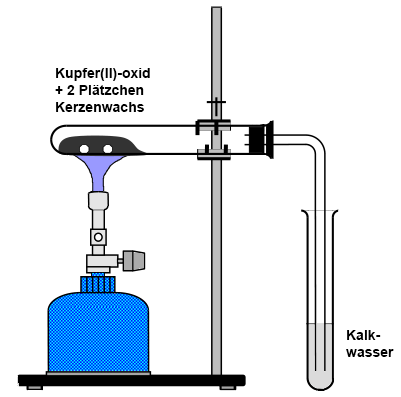
Beim Erhitzen einer kohlenstoffhaltigen
Substanz mit Kupfer(II)-oxid entsteht ebenfalls
Kohlenstoffdioxid, das mit Kalkwasser
nachgewiesen werden kann. Erhitzt man man zum Beispiel
Kerzenwachs-Plätzchen zusammen mit Kupfer(II)-oxid in einem
Reagenzglas, beschlägt sich der kühlere Rand des Reagenzglases
mit Wasserdampf, das Kupfer(II)-oxid färbt sich dabei rot. Über ein Glasrohr lassen sich die gasförmigen Produkte in ein Reagenzglas mit Kalkwasser leiten:
Bei der Verbrennung aller organischen Stoffe entsteht Kohlenstoffdioxid als Oxidationsprodukt der Kohlenstoff-Verbindungen. Bei Kohlenwasserstoffen erhält man auch Wasser als Verbrennungsprodukt:
Beim Einleiten von Kohlenstoffdioxid
in Kalkwasser entsteht eine weiße Trübung. Dabei fällt
wasserunlöslicher Kalk aus. Bei der Reaktion eines
Kohlenwasserstoffs mit Kupfer(II)-oxid wird dieses zu elementarem Kupfer
reduziert. Das entstehende Kupfer kann man an der roten Färbung erkennen.
Die dabei frei werdenden Sauerstoff-Atome oxidieren die Kohlenstoff-Atome
des Kohlenwasserstoffs zu Kohlenstoffdioxid und die Wasserstoff-Atome zu
Wasser:
Reduktion: 2 CuO
Oxidation 1: C-Atome + "O"
Oxidation 2: H-Atome + "O"
Elementaranalyse
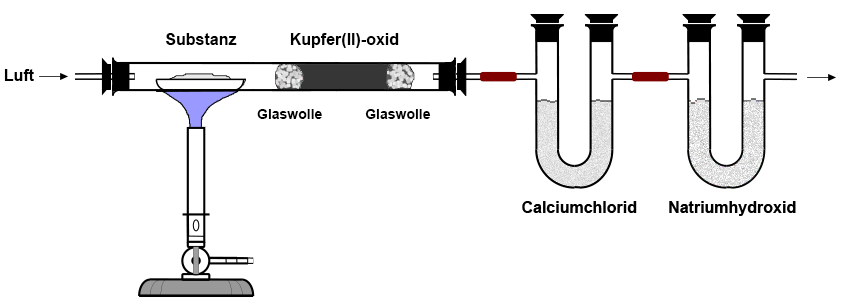
Dieses Verfahren wurde von Antoine Lavoisier erstmals angewandt, um das Verhältnis der Kohlenstoff-Atome zu den Wasserstoff-Atomen in einer chemischen Verbindung zu bestimmen. Justus von Liebig verbesserte das Verfahren. Fritz Pregl verfeinerte es soweit, dass es auch mit kleinen Stoffmengen durchgeführt werden konnte. Bei der Elementaranalyse wird die Substanz an glühendem Kupfer(II)-oxid CuO bei etwa 700 °C verbrannt. Zuerst wird das Kupfer(II)-oxid bis zum Glühen erhitzt, danach erhitzt man 0,5 Gramm der zu prüfenden organischen Substanz im Porzellan-Schiffchen. Nun wird reiner Sauerstoff oder Luft durch die Apparatur gesaugt. Die Verbrennungsprodukte H2O und CO2 werden in Absorptionsrohren oder in U-Rohren aufgefangen. Reines, getrocknetes Calciumchlorid absorbiert Wasser, feines Natriumhydroxid oder auch Kaliumhydroxid absorbieren Kohlenstoffdioxid. Aus der Massenzunahme der beiden U-Rohre lässt sich das prozentuale Verhältnis von Kohlenstoff und Wasserstoff errechnen.
Sicherheit 


Beim Verkohlen von Stoffen ist auf eine gute Raumlüftung zu achten. Es muss eine Schutzbrille getragen werden. Beim Arbeiten mit Natriumhydroxid oder Natronlauge sind auch Schutzhandschuhe notwendig. Reste der Kupfersalze werden im Behälter für Schwermetallsalz-Lösungen entsorgt.