| Inhalt Benennung Stoffbeispiele Herstellung Eigenschaften Verwendung | 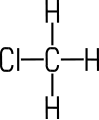 Chlormethan | Die
Halogenkohlenwasserstoffe als Stoffgruppe der organischen
Chemie enthalten im Grundgerüst einen Kohlenwasserstoff
und mindestens ein Halogen-Atom. Chlormethan ist ein einfacher Vertreter der Gruppe. |
Benennung der Halogenkohlenwasserstoffe
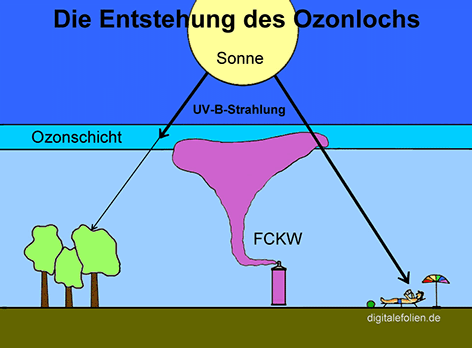
Die Moleküle der Halogenkohlenwasserstoffe enthalten ein Grundgerüst aus einem Kohlenwasserstoff, bei dem Wasserstoff-Atome durch Iod-, Brom-, Chlor- oder Fluor-Atome ersetzt sind. Sie sind vor allem durch die Fluorchlorkohlenwasserstoffe FCKW bekannt geworden. Diese gehören zu den Hauptverursachern des Ozonlochs. Aber auch einige andere Halogenkohlenwasserstoffe besitzen dieses Potenzial.
Nach der IUPAC-Nomenklatur
erfolgt die Benennung durch das Voransetzen der vorhandenen Halogen-Atome
vor dem Namen des Kohlenwasserstoff-Grundgerüstes. Sind mehrere Halogen-Atome in einem
Molekül enthalten, werden diese in alphabetischer Reihenfolge genannt. Bei den Fluorchlorkohlenwasserstoffen FCKW
ist auch die umgekehrte Reihenfolge üblich, weil sich das in der
Alltagssprache so eingebürgert hat. Bei der Summenformel werden
zuerst die C-, und die H-Atome aufgezählt, dann erst die
Halogen-Atome.
| Name IUPAC | Chlor- methan | Dichlor- methan |
Trichlor- methan |
Tetrachlor- methan |
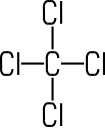
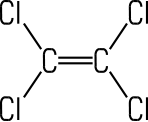
Tetrachlor- ethen |
| Struktur- formel |
 |
 |
 |
 |
 |
| Summen- formel |
CH3Cl | CH2Cl2 | CHCl3 | CCl4 | C2Cl4 |
| Trivialname | Methylchlorid | Methylenchlorid | Chloroform | Tetrachlorkohlenstoff | Per |
Beispiele für aliphatische Halogenkohlenwasserstoffe
Chlormethan (Methylchlorid)
Chlormethan ist ein farbloses, schwach
süßlich riechendes, giftiges Gas, das
narkotisierend wirkt.
Der Siedepunkt liegt bei −23,8 °C. Das Einatmen des Gases kann zu schweren Nervenschädigungen
führen. Leber-,
Nieren- und Herzversagen führen schließlich zum
Tode. Außerdem
steht es im Verdacht, eine krebserzeugende Wirkung zu
besitzen. Es wird
in der organischen Chemie als Zwischenprodukt zur Herstellung
von anderen
organischen Verbindungen benötigt. Chlormethan darf nicht
mit Alkali- oder Erdalkalimetallen in Berührung kommen, da hierbei
eine Explosion auftreten kann.
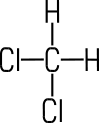
Dichlormethan (Methylenchlorid)
Dichlormethan
ist eine farblose, nicht
brennbare Flüssigkeit, die in Wasser schwer, in Alkohol
leicht löslich
ist. Der Siedepunkt liegt bei +40 °C. Die
Flüssigkeit verdampft bereits bei Raumtemperatur. Die Dämpfe
reizen die Augen, höhere
Konzentrationen führen
zu Rauschzuständen und Bewusstlosigkeit. Wie Chlormethan
steht es
im Verdacht, eine krebserzeugende Wirkung zu besitzen.
Es schädigt die Leber, das Blut und das zentrale Nervensystem. Nach neueren Untersuchungen kann es wie Tetrachlormethan die Ozonschicht zerstören.
Dichlormethan dient
als Lösungsmittel und Extraktionsmittel für
Öle, Coffein,
Harze, Wachse und ist in Fleckreinigungsmittel enthalten. Als
Begasungsmittel wird es wie Brommethan oder Dichlorethan in
Schiffscontainern zur Bekämpfung von Schädlingen eingesetzt.
Dies kann beim Öffnen eines solchen Containers, sofern er vorher
nicht intensiv belüftet wurde, bei den Werftarbeitern oder
LKW-Fahrern zu schweren Vergiftungen führen. Mit
Alkalimetallen oder mit Aluminium-Pulver reagiert Dichlormethan in einer
Explosion. Diese Reaktion hat schon mehrfach zu schweren Unfällen in Laboren geführt. Auch
die anderen Halogenalkane können mit Natrium oder Kalium explosiv
reagieren. Natrium darf zum Beispiel nicht zum Trocknen von
Halogenalkanen verwendet werden.
Trichlormethan (Chloroform)
Chloroform wurde früher als
Pflanzenschutzmittel und als Narkosemittel verwendet. Diese Anwendungen
sind heute verboten, da es Leberschäden verursacht und im Verdacht
steht, krebserzeugend zu wirken. Außerdem besaß das Narkosemittel
ein hohes Risiko: Viele Patienten starben an Herz- und Kreislaufversagen
während der Narkose. Im Labor wird die süßlich riechende,
farblose und nicht brennbare Flüssigkeit als Lösungsmittel verwendet.
Unter Lichteinfluss bildet sich Phosgen und Chlorwasserstoff, daher wird es
in braunen Flaschen aufbewahrt. Das käufliche Chloroform ist mit Ethanol stabilisiert, der mit dem entstehenden Phosgen reagiert und das Gas unschädlich
macht.
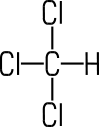
Tetrachlormethan (Tetrachlorkohlenstoff)
Das Halogenalkan Tetrachlorkohlenstoff ist eine farblose, nicht
brennbare Flüssigkeit, die in Wasser nur wenig, in Ethanol, Ether
oder Benzin gut löslich ist und fette Öle oder Harze gut löst.
Wie Chloroform ist es stark leberschädigend und gehört zu
den Stoffen mit einem möglichen krebserzeugenden Potenzial. Außerdem
ist es schädlich für Wasserorganismen und schädigt die Ozonschicht.
Tetrachlorkohlenstoff ist sehr reaktionsträge und wird von Säuren
und Laugen nicht angegriffen. Unter Licht- und Wärmeeinwirkung entsteht
besonders in Anwesenheit von Feuchtigkeit das Giftgas Phosgen.
Daher ist seine Anwendung als Feuerschutzmittel heute verboten. Gemische
mit Alkalimetallen wie Natrium und Kalium oder mit Aluminiumpulver können heftig
explodieren. Tetrachlorkohlenstoff darf aufgrund der möglichen Gefahren
nicht mehr als Lösungsmittel verwendet werden.
Tetrachlorethen (PER)
Das Halogenalken PER ist ebenfalls eine farblose
nicht brennbare Flüssigkeit und wird heute in chemischen Reinigungen
zur Textilreinigung eingesetzt. Es ist ein ausgezeichnetes Lösungsmittel
für tierische und pflanzliche Fette und Öle. Trotzdem ist seine
Verwendung sehr problematisch: Es wirkt wie die anderen Halogenkohlenwasserstoffe
leberschädigend und gehört zu den im Verdacht stehenden, krebserzeugenden
Stoffen. Problematisch sind eventuell vorhandene Rückstände in
Textilien aus der chemischen Reinigung. Kleidungsstücke aus der chemischen
Reinigung sollten daher vor dem Tragen gut ausgelüftet werden. Das
Auslüften darf nicht in Wohn- oder Schlafräumen erfolgen. Besser
ist jedoch der vollständige Verzicht auf das chemische Reinigen. Ein
Blick auf das Etikett beim Kauf genügt, um zu entscheiden, ob das
Kleidungsstück selbst gewaschen werden kann:

Enthält ein Molekül
zwei verschiedene Halogen-Atome, werden diese in der Reihe des Alphabets
genannt. Die vorangestellten Ziffern kennzeichnen die Stellung der Halogen-Atome:
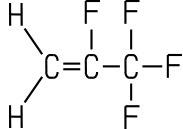
| Name (IUPAC) | Bromtrifluor- methan |
Dichlordifluor methan |
2-Brom-2-chlor 1,1,1-trifluorethan |
2,3,3,3-Tetra- fluorpropen |
| Struktur- formel |
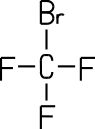 |
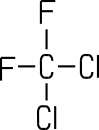 |
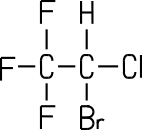 |
 |
| Trivialname | Halon 1301 | Frigen 12 |
Halothan | R-1234yf |
Bromtrifluormethan (Halon 1301)
Halon 1301 war früher aufgrund
seiner brandhemmenden Wirkung in Halon-Feuerlöschern enthalten. Die
Verwendung von Halonen in Feuerlöschern ist heute in Deutschland aufgrund der ozonschädigenden Wirkung nicht
mehr erlaubt. Als Halone werden alle brandhemmenden
Halogenkohlenwasserstoffe bezeichnet, zum Beispiel Tetrachlormethan (Halon 104),
Brommethan (Halon 1001) oder Bromchlordifluormethan (Halon 1211).
Dichlordifluormethan (Frigen 12)
Frigen 12 ist ein nicht
brennbares
Gas, das früher in großem Umfang in Kühlschränken
als komprimiertes Gas und als Treibgas in Spraydosen eingesetzt wurde.
Kohlenwasserstoffe
mit Chlor und Fluoratomen nennt man FCKW oder Fluorchlorkohlenwasserstoffe.
Diese Stoffe haben sich als Hauptverursacher für die Zerstörung
der lebensnotwendigen Ozonschicht in der Stratosphäre herausgestellt.
2-Brom-2-chlor-1,1,1-trifluorethan (Halothan)
Halothan ersetzt heute das früher
verwendete Chloroform als Narkosemittel. Es ist eine leicht flüchtige,
nicht brennbare Flüssigkeit mit einer Siedetemperatur von 50 °C.
Zur Narkose wird die Flüssigkeit verdampft und inhaliert. Bei wiederholten
Anwendungen kann es allerdings zu Leberschädigungen kommen.
2,3,3,3-Tetrafluorpropen (R-1234yf)
Das Halogenalken R-1234yf ist ein gasförmiges
Kältemittel für Kühlschränke und Klimaanlagen. Es greift
die Ozonschicht nicht an und zersetzt sich relativ schnell in der Atmosphäre.
Daher gilt es auch nicht als klimaschädigend. Allerdings entsteht
als Abbauprodukt die giftige Fluorverbindung Trifluoressigsäure. Beim
Einsatz in Klimaanlagen von Kraftfahrzeugen kann sich das Kältemittel
entzünden und Brände verursachen.
Herstellung der Halogenkohlenwasserstoffe
1. Herstellung eines Halogenalkans aus einem Alkan und einem Halogen
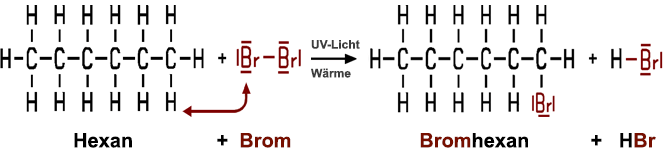
Ein Halogenalkan kann durch die Reaktion eines Alkans mit einem Halogen hergestellt werden. In einem Experiment lässt sich das gut zeigen: Zuerst wird in einem Rundkolben wenig Brom in Hexan gelöst. Diese Lösung wird längere Zeit einer UV-Lichtquelle ausgesetzt. Nach einer Weile beginnt sich die Lösung zu entfärben. Erhitzen und Schütteln beschleunigt die Entfärbung. Nach der Entfärbung wird ein Streifen Universalindikatorpapier über die Lösung gehalten. Das Papier färbt sich dabei rot.
Herstellung der Halogenkohlenwasserstoffe
1. Herstellung eines Halogenalkans aus einem Alkan und einem Halogen
Ein Halogenalkan kann durch die Reaktion eines Alkans mit einem Halogen hergestellt werden. In einem Experiment lässt sich das gut zeigen: Zuerst wird in einem Rundkolben wenig Brom in Hexan gelöst. Diese Lösung wird längere Zeit einer UV-Lichtquelle ausgesetzt. Nach einer Weile beginnt sich die Lösung zu entfärben. Erhitzen und Schütteln beschleunigt die Entfärbung. Nach der Entfärbung wird ein Streifen Universalindikatorpapier über die Lösung gehalten. Das Papier färbt sich dabei rot.

Ein Kolben mit einer Lösung von Brom in Hexan wird vor einer UV-Quelle geschüttelt.
Nach der Entfärbung wird ein Streifen Universalindikatorpapier darüber gehalten.
Dieser Versuch ist für Schulen problematisch. >Film
Wie lassen sich die beobachteten Phänomene erklären? Das Brom reagiert mit dem Hexan, wenn UV-Licht vorhanden ist. Dass dabei eine Reaktion stattfindet, ist an der Entfärbung zu erkennen. Die Rotfärbung des Universalindikators weist darauf hin, dass gleichzeitig eine Säure entstanden ist. Das Hexan reagiert mit dem Brom zu den farblosen Produkten Bromhexan und Bromwasserstoff:
C6H14 + Br2 C6H13Br + HBr
C6H13Br + HBr
Hexan + Brom Bromhexan + Bromwasserstoff
Bromhexan + Bromwasserstoff
Es entstehen dabei verschiedene Isomere des Bromhexans, hauptsächlich 2-Bromhexan und 3-Bromhexan. Da ein Wasserstoff-Atom im Hexan durch ein Brom-Atom im Austausch ersetzt wird, nennt man diesen Reaktionstyp Substitution.
C6H14 + Br2
Hexan + Brom
Es entstehen dabei verschiedene Isomere des Bromhexans, hauptsächlich 2-Bromhexan und 3-Bromhexan. Da ein Wasserstoff-Atom im Hexan durch ein Brom-Atom im Austausch ersetzt wird, nennt man diesen Reaktionstyp Substitution.
Methan reagiert mit Chlor nach dem gleichen Prinzip. Dabei entstehen unter dem Einfluss von UV-Licht (und Wärme) Chlormethan und Chlorwasserstoff.
CH4 + Cl2 CH3Cl + HCl
CH3Cl + HCl
Methan + Chlor Chlormethan + Chlorwasserstoff
Chlormethan + Chlorwasserstoff
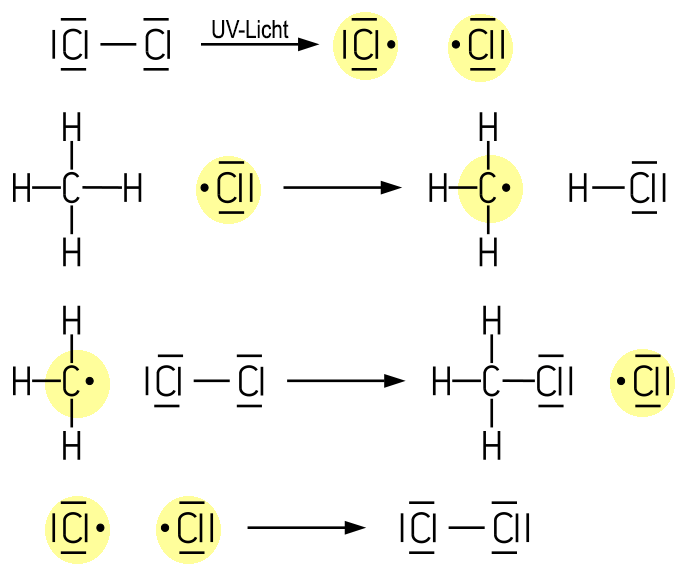
Der Reaktionsmechanismus dieser Radikalischen Substitution SR kann so erklärt werden: Zuerst werden die Chlor-Moleküle durch UV-Licht gespalten, so dass jeweils zwei Chlor-Radikale entstehen. Ein Chlor-Radikal reagiert mit einer C-H-Bindung des Methans und nimmt dabei ein H-Atom auf. Es entsteht ein Methyl-Radikal und ein Chlorwasserstoff-Molekül. Das Methyl-Radikal reagiert mit einem weiteren Chlor-Molekül, wobei ein Chlormethan-Molekül und erneut ein Chlor-Radikal gebildet werden. Dieser Mechanismus stellt eine radikalische Kettenreaktion dar und wiederholt sich, solange ausreichend Reaktionspartner vorhanden sind. Im idealisierten Modell benötigt die Reaktion nur zu Beginn UV-Licht zur Radikalbildung. Die Kettenreaktion endet, wenn Radikale miteinander reagieren, wenn das Chlor aufgebraucht ist oder wenn Radikale durch Verunreinigungen abgefangen werden. Das Schaubild zeigt einen möglichen Abbruch:
CH4 + Cl2
Methan + Chlor
Der Reaktionsmechanismus dieser Radikalischen Substitution SR kann so erklärt werden: Zuerst werden die Chlor-Moleküle durch UV-Licht gespalten, so dass jeweils zwei Chlor-Radikale entstehen. Ein Chlor-Radikal reagiert mit einer C-H-Bindung des Methans und nimmt dabei ein H-Atom auf. Es entsteht ein Methyl-Radikal und ein Chlorwasserstoff-Molekül. Das Methyl-Radikal reagiert mit einem weiteren Chlor-Molekül, wobei ein Chlormethan-Molekül und erneut ein Chlor-Radikal gebildet werden. Dieser Mechanismus stellt eine radikalische Kettenreaktion dar und wiederholt sich, solange ausreichend Reaktionspartner vorhanden sind. Im idealisierten Modell benötigt die Reaktion nur zu Beginn UV-Licht zur Radikalbildung. Die Kettenreaktion endet, wenn Radikale miteinander reagieren, wenn das Chlor aufgebraucht ist oder wenn Radikale durch Verunreinigungen abgefangen werden. Das Schaubild zeigt einen möglichen Abbruch:
2. Herstellung eines Halogenalkans aus einem Alken (oder einem Alkin) und einem Halogen
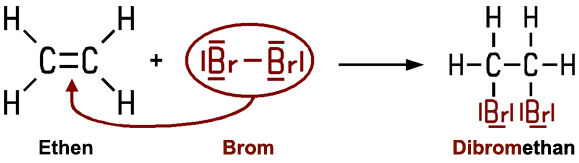
Halogenalkane lassen sich auch durch die Reaktion eines Halogens mit einem Alken oder einem Alkin herstellen. Leitet man zum Beispiel Ethen in einen Standzylinder, der mit Bromdämpfen gefüllt ist, verschwindet die rotbraune Farbe des Broms allmählich. Entscheidend dabei ist, dass diese Reaktion von alleine, also ohne UV-Licht oder Wärme stattfindet:
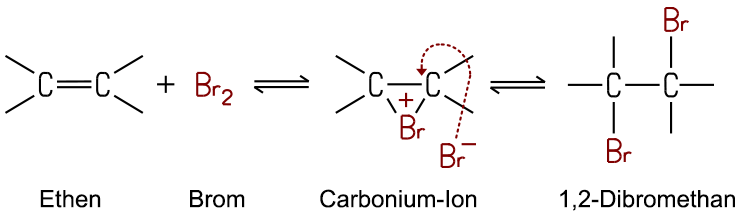
Diese Reaktion findet immer statt, wenn Kohlenstoff-Mehrfachbindungen vorliegen, sie gilt als Nachweisreaktion für Doppel- oder Dreifachbindungen. In der Laborpraxis wird dafür Bromwasser verwendet, das sich beim Vorhandensein einer Doppelbindung entfärbt. Wie lässt sich das Phänomen erklären? Die Zweifachbindung im Ethen-Molekül ist chemisch nicht stabil und sehr reaktionsfähig. Bei einem geeigneten Reaktionspartner bricht sie auf und die beiden Brom-Atome werden aufgenommen. Dabei entsteht ein 1,2-Dibromethan-Molekül. Da in ein bestehendes Molekül Atome aufgenommen werden, nennt man diesen Reaktionstyp Addition.
3. Herstellung eines Halogenalkans aus einem Alken und einem Halogenwasserstoff
Eine weitere Herstellungsmöglichkeit der Halogenalkane ist die Reaktion von einem Alken mit Bromwasserstoff beim Vorhandensein von Peroxid, das Radikale liefert. Diese Reaktion findet in der Gasphase oder in einem unpolaren Lösungsmittel statt, weil polare Lösungsmittel die Reaktion verhindern würden.
CH3–CH=CH2 + HBr CH3–CH2–CH2Br
CH3–CH2–CH2Br
Propen + Bromwasserstoff 1-Brompropan
1-Brompropan
Eigenschaften der Halogenkohlenwasserstoffe
Die meisten Halogenkohlenwasserstoffe haben ein gutes Lösungsvermögen für organische Lösungsmittel. Da die Kohlenstoff-Halogen-Bindung schwach polar ist, besitzen die Halogenalkane einen höheren Siedepunkt als ein entsprechendes Alkan. Sie sind aber nicht wasserlöslich, weil ihre Moleküle keine Wasserstoffbrückenbindungen eingehen können. Da sie nicht brennbar sind, wirken sie auch flammhemmend. Viele sind stark toxisch, schädigen die Leber oder können Krebs erzeugen. Einige wirken narkotisierend. FCKW's und einige andere zerstören die Ozonschicht.
1,2-Dibromethan reagiert mit Zinkpulver
Die Halogen-Atome in den Molekülen der Halogenkohlenwasserstoffe können dazu dienen, andere organische Stoffe herzustellen. Wenn man 1,2-Dibromethan und Zinkpulver erhitzt, wird ein Gas freigesetzt, das man in einer pneumatischen Wanne in einem Reagenzglas auffangen kann. Das Gas ist leicht entzündbar und brennt mit rußender Flamme.

1,2-Dibromethan wird mit Zinkpulver erhitzt. Das entstehende Gas wird pneumatisch aufgefangen.
Dieser Versuch ist für Schulen problematisch. >Film
Die leicht rußende Flamme weist auf Ethen hin. Die Reaktion hat keine technische Bedeutung, weil Ethen auf anderem Weg viel günstiger hergestellt werden kann. Das 1,2-Dibromethan reagiert mit dem Zinkpulver zu Ethen und Zinkbromid:
C2H4Br2 + Zn C2H4 + ZnBr2
C2H4 + ZnBr2
1,2-Dibromethan + Zink Ethen + Zinkbromid
Ethen + Zinkbromid
Diese Reaktion ist eine Eliminierungsreaktion im allgemeinen Sinn und aber auch eine klassische Redoxreaktion, bei der in einer Reduktiven Dehalogenierung zwei Halogen-Atome von benachbarten C-Atomen entfernt werden und ein Ethen-Molekül entsteht. Zink wirkt als Reduktionsmittel und gibt Elektronen ab, es wird dabei oxidiert. Die beiden C-Br-Bindungen nehmen Elektronen auf und werden reduziert. Die Reaktion kann nicht mit einem speziellen Eliminierungsmechanismus erklärt werden, auch wenn sie oft im Chemieunterricht als Beispiel für eine Eliminierung herangezogen wird. Da 1,2-Dibromethan krebserzeugend ist, darf das Experiment an Schulen nicht mehr durchgeführt werden.
Iodmethan reagiert mit Natriumhydroxid
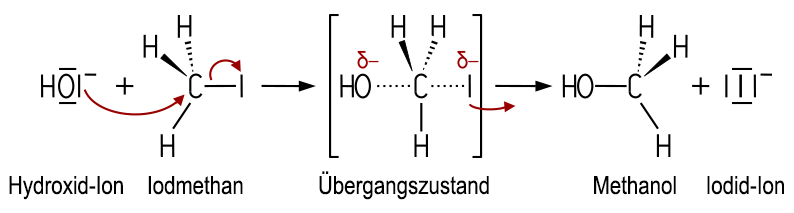
Die Halogen-Atome können auch durch eine Substitutionsreaktion ersetzt werden. Erhitzt man zum Beispiel Iodmethan mit Natriumhydroxid, erhält man Methanol und Natriumiodid. Das Iod-Atom wird durch eine Hydroxy-Gruppe ersetzt:
CH3I + Na+OH− CH3OH + Na+I−
CH3OH + Na+I−
Iodmethan + Natriumhydroxid Methanol + Natriumiodid
Methanol + Natriumiodid
Der Reaktionsmechanismus ist ein Musterbeispiel für eine Nukleophile Substitution des Typs SN2. Das nukleophile Hydroxid-Ion greift an der gegenüberliegenden Seite der C-I-Bindung im Iodmethan-Molekül an. Dabei wird gleichzeitig eine neue C-O-Bindung gebildet und die C-I-Bindung gelöst. Diese Reaktion erfolgt in einem Schritt über einen Übergangszustand unter Inversion der Konfiguration zur Bildung von Methanol und einem Iodid-Ion:
Verwendung der Halogenkohlenwasserstoffe
Halogenkohlenwasserstoffe werden als Lösungsmittel, Treibmittel, Kühlmittel, Narkosemittel und auch zur Flammhemmung eingesetzt. Aufgrund ihres gefährlichen Potenzials ist der Einsatzbereich der meisten Stoffe für Experimente an Schulen stark eingeschränkt!
Insektizide wie DDT oder Lindan zählen ebenfalls zu den Halogenkohlenwasserstoffen. DDT ist ein aromatischer Halogenkohlenwasserstoff, Lindan ein cyclischer. Der Einsatz der beiden Stoffe ist heute in der EU und in der Schweiz verboten. DDT ist ein starkes Insektengift für Stechmücken und anderes Ungeziefer. Lindan wurde in Holzschutzmitteln, als Ameisengift oder zur Mottenbekämpfung eingesetzt. Es kann Säuglinge über die Muttermilch schädigen. Bei langanhaltender Aufnahme kleiner Mengen kann es zu chronischen Schäden am Zentralnervensystem kommen.
Halogenalkane lassen sich auch durch die Reaktion eines Halogens mit einem Alken oder einem Alkin herstellen. Leitet man zum Beispiel Ethen in einen Standzylinder, der mit Bromdämpfen gefüllt ist, verschwindet die rotbraune Farbe des Broms allmählich. Entscheidend dabei ist, dass diese Reaktion von alleine, also ohne UV-Licht oder Wärme stattfindet:
Diese Reaktion findet immer statt, wenn Kohlenstoff-Mehrfachbindungen vorliegen, sie gilt als Nachweisreaktion für Doppel- oder Dreifachbindungen. In der Laborpraxis wird dafür Bromwasser verwendet, das sich beim Vorhandensein einer Doppelbindung entfärbt. Wie lässt sich das Phänomen erklären? Die Zweifachbindung im Ethen-Molekül ist chemisch nicht stabil und sehr reaktionsfähig. Bei einem geeigneten Reaktionspartner bricht sie auf und die beiden Brom-Atome werden aufgenommen. Dabei entsteht ein 1,2-Dibromethan-Molekül. Da in ein bestehendes Molekül Atome aufgenommen werden, nennt man diesen Reaktionstyp Addition.

Zum genaueren Verständnis wird der Reaktionsmechanismus erläutert: Die Doppelbindung besitzt bewegliche π-Elektronen. Diese verschieben beim Annähern die Elektronen im Brom-Molekül, so dass ein positiv polarisiertes Brom-Atom Brδ+ entsteht, das elektrophil wirkt. Die π-Elektronen der Doppelbindung greifen das elektrophile Brom-Atom an, wodurch die Br-Br-Bindung aufbricht. Als Zwischenstufe entsteht ein Bromonium-Ion, ein dreigliedriger Ring mit positiver Ladung am Brom-Atom. Das gleichzeitig gebildete, nukleophile Bromid-Ion Br− sucht die Bindung an einem der Kohlenstoff-Atome des Bromonium-Ions, es öffnet den Ring und addiert sich ebenfalls in das Molekül. Da die Bildung der Bindung durch ein elektrophiles Teilchen
(Brδ+) eingeleitet wird, handelt es sich hier um eine Elektrophile Addition (AE).
3. Herstellung eines Halogenalkans aus einem Alken und einem Halogenwasserstoff
Eine weitere Herstellungsmöglichkeit der Halogenalkane ist die Reaktion von einem Alken mit Bromwasserstoff beim Vorhandensein von Peroxid, das Radikale liefert. Diese Reaktion findet in der Gasphase oder in einem unpolaren Lösungsmittel statt, weil polare Lösungsmittel die Reaktion verhindern würden.
CH3–CH=CH2 + HBr
Propen + Bromwasserstoff
Eigenschaften der Halogenkohlenwasserstoffe
Die meisten Halogenkohlenwasserstoffe haben ein gutes Lösungsvermögen für organische Lösungsmittel. Da die Kohlenstoff-Halogen-Bindung schwach polar ist, besitzen die Halogenalkane einen höheren Siedepunkt als ein entsprechendes Alkan. Sie sind aber nicht wasserlöslich, weil ihre Moleküle keine Wasserstoffbrückenbindungen eingehen können. Da sie nicht brennbar sind, wirken sie auch flammhemmend. Viele sind stark toxisch, schädigen die Leber oder können Krebs erzeugen. Einige wirken narkotisierend. FCKW's und einige andere zerstören die Ozonschicht.
1,2-Dibromethan reagiert mit Zinkpulver
Die Halogen-Atome in den Molekülen der Halogenkohlenwasserstoffe können dazu dienen, andere organische Stoffe herzustellen. Wenn man 1,2-Dibromethan und Zinkpulver erhitzt, wird ein Gas freigesetzt, das man in einer pneumatischen Wanne in einem Reagenzglas auffangen kann. Das Gas ist leicht entzündbar und brennt mit rußender Flamme.

1,2-Dibromethan wird mit Zinkpulver erhitzt. Das entstehende Gas wird pneumatisch aufgefangen.
Dieser Versuch ist für Schulen problematisch. >Film
Die leicht rußende Flamme weist auf Ethen hin. Die Reaktion hat keine technische Bedeutung, weil Ethen auf anderem Weg viel günstiger hergestellt werden kann. Das 1,2-Dibromethan reagiert mit dem Zinkpulver zu Ethen und Zinkbromid:
C2H4Br2 + Zn
1,2-Dibromethan + Zink
Diese Reaktion ist eine Eliminierungsreaktion im allgemeinen Sinn und aber auch eine klassische Redoxreaktion, bei der in einer Reduktiven Dehalogenierung zwei Halogen-Atome von benachbarten C-Atomen entfernt werden und ein Ethen-Molekül entsteht. Zink wirkt als Reduktionsmittel und gibt Elektronen ab, es wird dabei oxidiert. Die beiden C-Br-Bindungen nehmen Elektronen auf und werden reduziert. Die Reaktion kann nicht mit einem speziellen Eliminierungsmechanismus erklärt werden, auch wenn sie oft im Chemieunterricht als Beispiel für eine Eliminierung herangezogen wird. Da 1,2-Dibromethan krebserzeugend ist, darf das Experiment an Schulen nicht mehr durchgeführt werden.
Iodmethan reagiert mit Natriumhydroxid
Die Halogen-Atome können auch durch eine Substitutionsreaktion ersetzt werden. Erhitzt man zum Beispiel Iodmethan mit Natriumhydroxid, erhält man Methanol und Natriumiodid. Das Iod-Atom wird durch eine Hydroxy-Gruppe ersetzt:
CH3I + Na+OH−
Iodmethan + Natriumhydroxid
Der Reaktionsmechanismus ist ein Musterbeispiel für eine Nukleophile Substitution des Typs SN2. Das nukleophile Hydroxid-Ion greift an der gegenüberliegenden Seite der C-I-Bindung im Iodmethan-Molekül an. Dabei wird gleichzeitig eine neue C-O-Bindung gebildet und die C-I-Bindung gelöst. Diese Reaktion erfolgt in einem Schritt über einen Übergangszustand unter Inversion der Konfiguration zur Bildung von Methanol und einem Iodid-Ion:
Verwendung der Halogenkohlenwasserstoffe
Halogenkohlenwasserstoffe werden als Lösungsmittel, Treibmittel, Kühlmittel, Narkosemittel und auch zur Flammhemmung eingesetzt. Aufgrund ihres gefährlichen Potenzials ist der Einsatzbereich der meisten Stoffe für Experimente an Schulen stark eingeschränkt!
| DDT | Lindan |
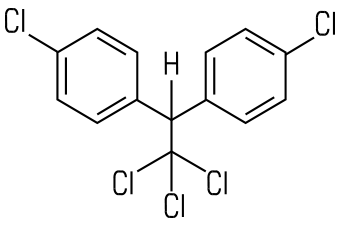 | 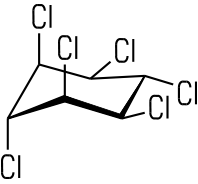 |
| Alte Bezeichnung: Dichlordiphenyltrichlorethan IUPAC: 1,1,1-Trichlor-2,2-bis(4-chlorphenyl)ethan | Alte Bezeichnung: Gammexan IUPAC: γ-Hexachlorcyclohexan |
Insektizide wie DDT oder Lindan zählen ebenfalls zu den Halogenkohlenwasserstoffen. DDT ist ein aromatischer Halogenkohlenwasserstoff, Lindan ein cyclischer. Der Einsatz der beiden Stoffe ist heute in der EU und in der Schweiz verboten. DDT ist ein starkes Insektengift für Stechmücken und anderes Ungeziefer. Lindan wurde in Holzschutzmitteln, als Ameisengift oder zur Mottenbekämpfung eingesetzt. Es kann Säuglinge über die Muttermilch schädigen. Bei langanhaltender Aufnahme kleiner Mengen kann es zu chronischen Schäden am Zentralnervensystem kommen.
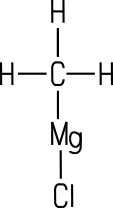
| Bedeutung der Grignard-Verbindungen | |||
|
Buch individuell erstellen: Basis-Text Halogenkohlenwasserstoffe


> Inhaltsverzeichnis