Teflonverschluss |
 Farblose bis rötliche Kristalle Vorkommen Kiefer (Holz und Nadeln), Harn von Pflanzenfressern, Steinkohleteer |
Molmasse 94,111 g/mol AGW 8 mg/m3 (TRGS 900) Dichte 1,0545 g/cm3 Schmelzpunkt +40,89 °C Siedepunkt +181,8 °C Wasserlöslichkeit Konz. bei 20 °C 82 g/l Explosionsgrz. 1,8 bis 8,6 Vol.-% (Luft) Flammpunkt +79 °C Zündpunkt +715 °C |
| Piktogramme GHS 05 GHS 06 GHS 08 GHS 09 Gefahr |
Gefahrenklassen
+ Kategorie Akute Toxizität oral 3 Akute Toxizität dermal 3 Akute Toxizität inhalativ 3 Ätz-/Reizwirkung auf die Haut 1B Keimzellenmutagenität 2 Spez. Zielorgantoxizität w. 2 Gewässergefährdend chron. 2 |
HP-Sätze (siehe auch Hinweis) H 301, 311, 314, 331, 341, 373, 411 P 260, 280.1-3,7, 301+330+331+310, 303+361+353, 305+351+338, 304+340+310 Entsorgung G 3 |
| Etikett drucken | Dt. Bezeichnung Synonyme (deutsch) |
Engl. Bezeichnung Synonyme (engl.) |
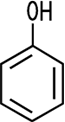
| CAS 108-95-2 | Phenol Hydroxybenzol Carbolsäure |
Phenol Hydroxybenzene Carbolic acid |
Bemerkung
für Schulen: Es wird empfohlen, auf Schülerversuche mit Phenol
zu verzichten. Der Stoff verdampft bereits bei Zimmertemperatur. Für
das Arbeiten mit Phenol ist ein Abzug notwendig. Die Flaschen sollten eine Teflondichtung besitzen.
Wirkung auf den menschlichen Körper Auf der Haut wirkt Phenol stark ätzend. Durch die bloße Berührung kann es absorbiert und über die Haut ins Blut aufgenommen werden. Die Aufnahme in den Körper über die Haut, durch das Einatmen der Dämpfe oder über den Verdauungstrakt führt zur Atemlähmung und zum Herzstillstand. Chronische Langzeitvergiftungen in Form von Nierenschäden sind ebenfalls bekannt. Phenol wirkt auch stark keimtötend und desinfizierend. Es ist stärker toxisch als die Diphenole wie beispielsweise Resorcin. Als tödliche Dosis gelten 10 bis 30 Gramm Phenol. Eigenschaften Phenol bildet farblose,
durchsichtig erscheinende Nadeln oder kristalline Formen, die durchdringend
riechen und scharf brennend schmecken. Durch Wasseraufnahme zerfließen
die Nadeln allmählich an der Luft, durch Licht und Luft verfärben
sie sich rötlich.
Phenol ist in Wasser
und Benzol nur mäßig löslich,
dafür umso besser in Ethanol, Ether,
Chloroform, Fetten und etherischen Ölen, in
wässrigen Laugen
und in unverzweigten Kohlenwasserstoffen. Phenol
verhält sich im Wasser als schwache Säure und gibt Protonen
ab. Die Siedetemperatur ist rund
100 °C höher als die von Benzol, was
auf die Hydroxy-Gruppe zurückzuführen ist. Phenol ist sehr reaktionsfähig.
Mit Natronlauge bildet sich das Salz Natriumphenolat C6H5O−Na+: C6H5OH + NaOH |
Die
Wasserstoff-Atome
im aromatischen Ring des Phenols lassen sich leicht
substituieren. Bei der Bromierung von Phenol in Schwefelkohlenstoff
erhält man unter Bromwasserstoffabgabe ein
Gemisch verschiedener Bromphenole, bei denen das Brom-Atom an
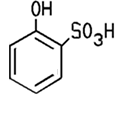
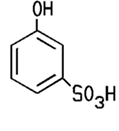
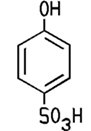
verschiedenen Stellen sitzt. C6H5OH + Br2 Mit konzentrierter Schwefelsäure findet eine Sulfonierung statt, man erhält dabei vor allem 4-Phenolsulfonsäure. Diese dient
zur Herstellung von Farbstoffen oder Waschmitteln. Eine energische
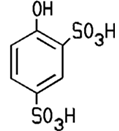
Sulfonierung des Phenols führt zu 2,4-Phenoldisulfonsäure.
C6H5OH + H2SO4
Die
halogenierten oder
sulfonierten Produkte eignen sich zur
Weiterverarbeitung und zur Herstellung
der anderen Phenole, beispielsweise für
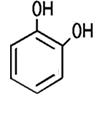
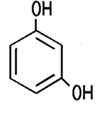
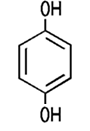
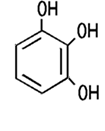
Brenzcatechin, Resorcin, Hydrochinon oder Pyrogallol. Je nach Stellung
und Anzahl der Hydroxy-Gruppen erhält man verschiedene Stoffe mit
unterschiedlichen Eigenschaften:
Mit verdünnter Salpetersäure erhält man ein Gemisch verschiedener Nitrophenole, die alle gelbe bis hellgelbe oder fast weiße nadelförmige Kristalle bilden. Die Eigenschaften der Nitrophenole hängen von der Stellung der NO2-Gruppe ab. C6H5OH + HNO3
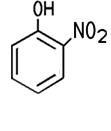
2-Nitrophenol
wird zur Herstellung
von Arzneimitteln, Insektiziden oder Riechstoffen
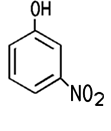
verwendet. 3-Nitrophenol und 4-Nitrophenol werden beide als Indikator
eingesetzt. Das energische Nitrieren
mit konzentrierter Salpetersäure führt nur
zu
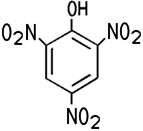
Dinitrophenol. 2,4,6-Trinitrophenol lässt sich nur durch Nitrierung
aus Phenol-2,4-disulfonsäure
darstellen. Der Explosivstoff ist unter dem Namen
Pikrinsäure bekannt.
2-Nitrophenol (links) und 4-Nitrophenol (rechts) |
| Herstellung Früher gewann man das Phenol aus dem Mitteldestillat bei der Destillation von Steinkohleteer. Durch Zugabe von Natronlauge zum Destillat erhielt man Natriumphenolat, das durch eine Zugabe von Salzsäure in Phenol zersetzt werden konnte. Heute existieren zahlreiche Herstellungsverfahren. Das bedeutendste ist die Synthese aus Cumol. Dieses wird aus Benzol und Propen hergestellt. Bei der Oxidation mit Sauerstoff entsteht aus Cumol zunächst Cumolhydroperoxid, das dann unter dem Einfluss von starken Säuren in Phenol und Aceton zerfällt: 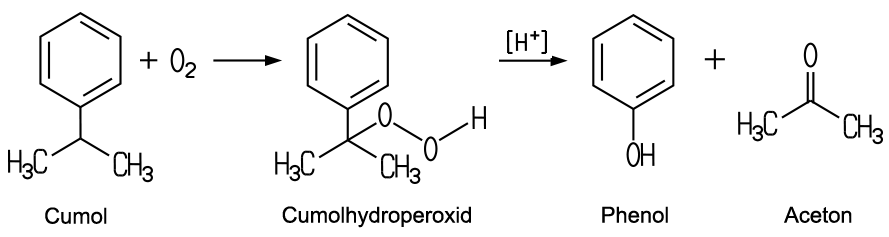 |
| Verwendung Phenol dient zur Herstellung
zahlreicher anderer organischer Verbindungen, wie Brenzcatechin, Resorcin, Anilin, Salicylsäure, Pikrinsäure, Phenolphthalein, Chlorpenole, Phenolharze,
Caprolactam, Weichmacher oder Adipinsäure. Phenol wird auch als Lösungsmittel
eingesetzt und in der Mikroskopie als Färbemittel verwendet. Gelegentlich
findet man es in Desinfektionsmitteln oder in minimalen Konzentrationen
in Seifen und Shampoos. |